Биоптат кожи, заливался 1 мл 0,9 % водного раствора хлорида натрия и помещался в рабочую камеру автоматической системы для механической гомогенизации ткани Medimachine (Becton Dickinson, США).
Гомогенизация ткани проводилась в течение 30 секунд при температуре +23 °С. Гомогенат извлекался стерильным шприцем. Рабочая камера гомогенизатора трижды вымывалась 0,9 % водным раствором хлорида натрия по 1 мл. Затем гомогенат фильтровался через инертный фильтр для клеток с нейлоновой сетчатой структурой и диаметром пор 20 мкм. Далее гомогенат центрифугировался для удаления надосадочной жидкости при 400 g и температуре +23 °С в течение 5 минут.
Полученный образец кожи, согласно авторской технологии [53], описанной в полученном патенте на изобретение «Способ получения жизнеспособной гетерогенной популяции клеток кожи» (Приложение 1), исследовался ex tempore и после криоконсервации методом проточной цитометрии с фенотипированием клеточной суспензии. Для второго варианта проверенный на стерильность образец помещался в криопробирку Costar 2 мл с раствором для замораживания (90 % Fetal Bovine Serum и 10 % DMSO в качестве криопротектора), затем образец замораживался в парах жидкого азота при t° -140 °C со скоростью 1 °C в минуту методом витрификации.
Клетки кожи инкубировались в течение 20 минут в защищенном от света месте с моноклональными антителами, конъюгироваными с флюорохромами: флюоресцеинизотиоцианатом (FITC), фикоэритрином (РЕ – Texasred (ESD)), PE/CY5(PC5), PE/CY7(PC7).
Жизнеспособность клеток определялась с помощью внутриклеточного красителя 7-amino-actinomycin D RUO (7AAD).
Принципиальная схема способа представлена на рис. 3.1.
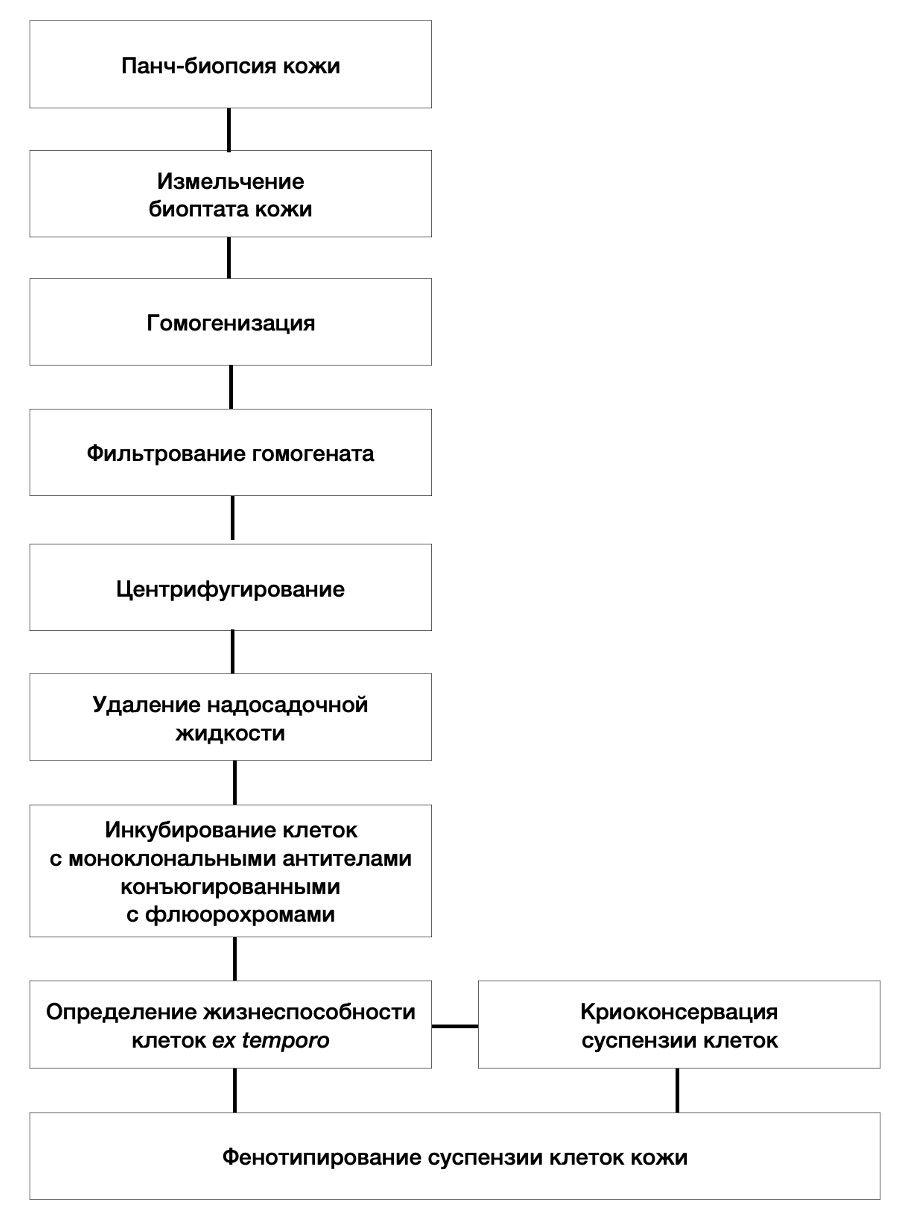
Рисунок 3.1. Принципиальная схема пробоподготовки жизнеспособной гетерогенной популяции клеток кожи для фенотипирования с целью прецизионной диагностики
Учитывая сведения литературного обзора, нами была определена панель маркеров дифференцирования клеток, наиболее точно характеризующих динамику состояний основных субпопуляций клеток кожи:
Этот выбор стал основанием регистрации Патента на изобретение «Способ определения субпопуляционного состава клеток кожи и получения цитоиммунограммы кожи» (Приложение 2).
Для регистрации получаемых результатов был разработан бланк медицинского документа «Цитоиммунограмма кожи», в котором представлен состав клеток кожи, с указанием фенотипа каждой субпопуляции для заполнения лаборантом числовых данных в относительных и/или абсолютных единицах по результатам исследования (рис. 3.2).
В верхней части документа указываются реквизиты медицинского учреждения, знак обслуживания, почтовый адрес, контактные телефоны, сайт медицинского учреждения, а также свободные участки для заполнения лаборантом идентификационного номера цитоиммунограммы кожи с датой проведения анализа, фамилии имени отчества пациента и его возраста.
В средней части документа в две колонки представлен состав клеток кожи, с указанием фенотипа каждой популяции. Напротив каждой группы клеток кожи предусмотрены пустые поля в виде сдвоенных прямоугольников для заполнения лаборантом числовых данных в относительных и/или абсолютных единицах по результатам экспериментов. Представленные числовые данные указывают количество клеток кожи определенного фенотипа.
В нижней части документа имеются свободные участки, предназначенные для заполнения информации о результатах исследования фенотипа клеток кожи, которые могут свидетельствовать: о динамической оценке течения заболевания, эффективности использования назначенных лекарственных или косметических средств, оценке возрастных изменений кожи, индивидуальном подборе лекарственных препаратов, оценке степени реагирования клеток кожи на те или иные воздействия. Также заполняются лаборантом сведения об исполнителе и враче, направившим на проведение анализа.

Рисунок 3.2. Бланк медицинского документа «Цитоиммунограмма кожи».
После пробоподготовки, описанной выше, у пациента А. 42 лет, методом проточной цитометрии определяли количество жизнеспособных клеток кожи у одного из добровольцев (рис. 3.3). Результат составил 94%.
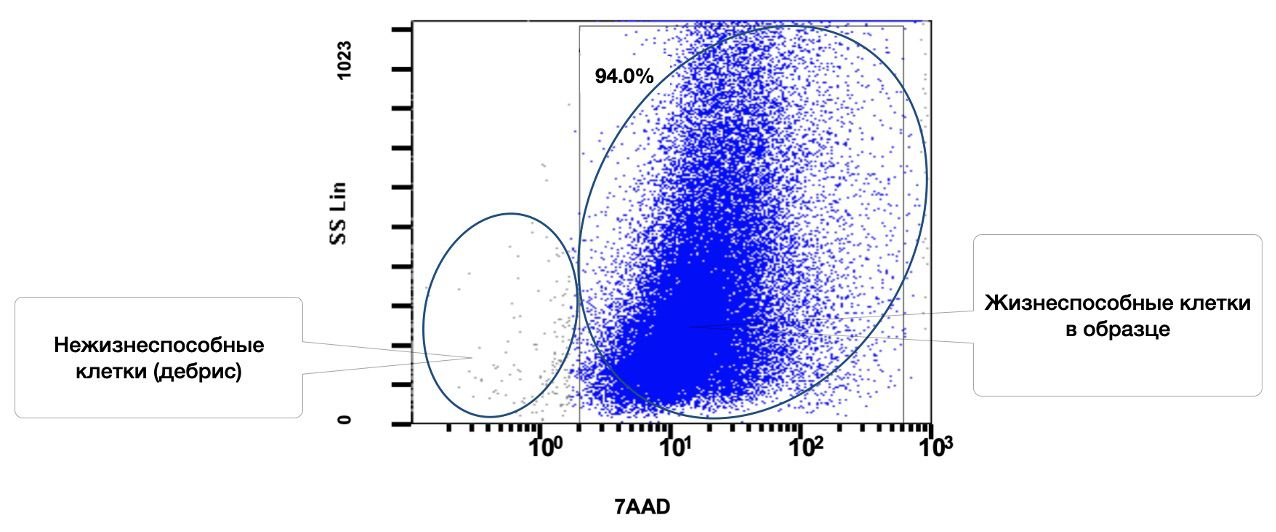
Рисунок 3.3. Относительное количество всех жизнеспособных (7AAD) клеток в суспензии образца кожи полученное методом проточной цитометрии
Также регистрировали количество клеток определенных фенотипов, используя наборы моноклональных антител меченые флюорохромами и связывающиеся с определёнными рецепторами на мембране клетки.
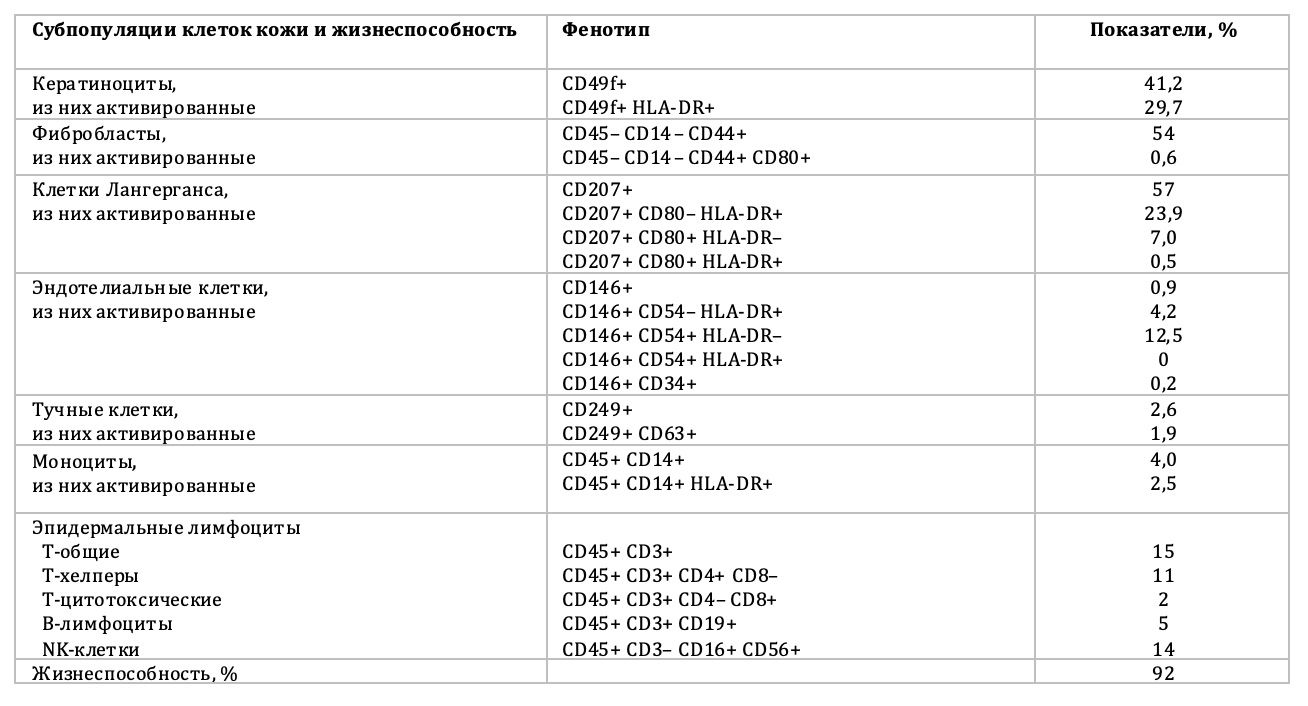
Показано, что в образце кожи 54,2% кератиноцитов, из них в состоянии активности 41,4% (рис. 3.4).
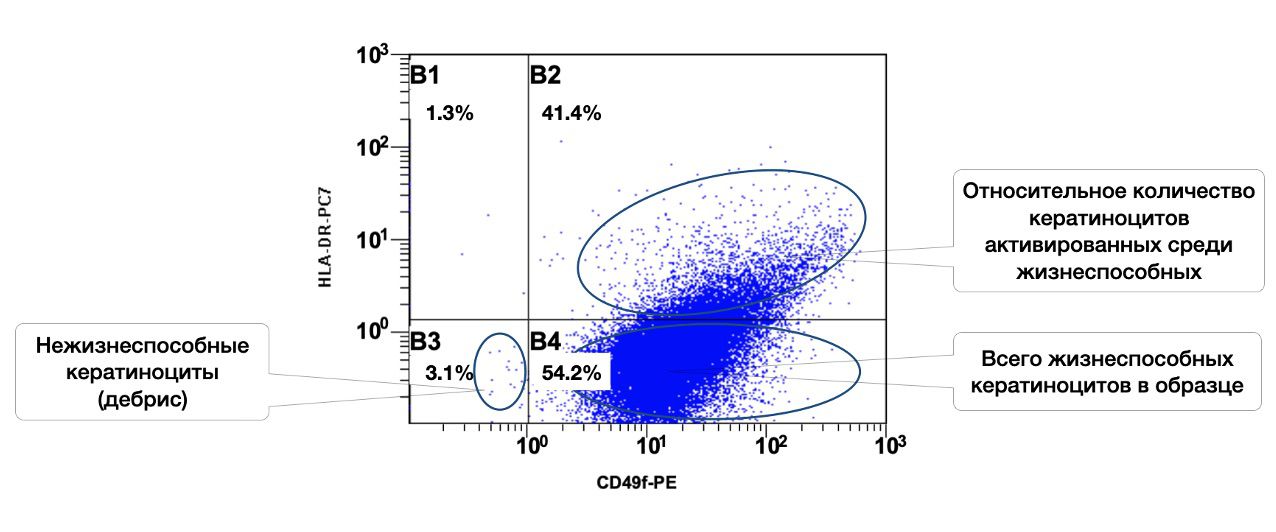
Рисунок 3.4. Соотношение относительного количества жизнеспособных кератиноцитов (фенотип CD49f+) и их активированных форм (фенотип CD49f+HLA-DR+) в суспензии клеток биоптата кожи человека, полученное методом проточной цитометрии
Также в образце кожи, среди 86% жизнеспособных фибробластов, 6,2% в состоянии активности (рис. 3.5 и 3.6).
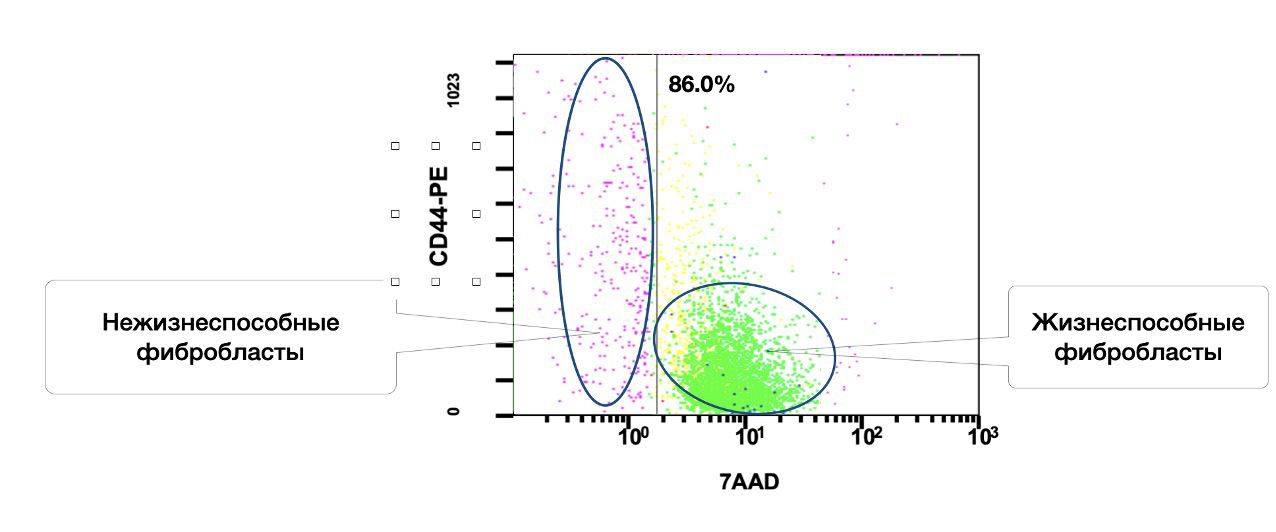
Рисунок 3.5. Относительное количество жизнеспособных (7AAD) фибробластов (фенотип CD45-CD14-CD44+) в суспензии клеток биоптата кожи человека, полученное методом проточной цитометрии
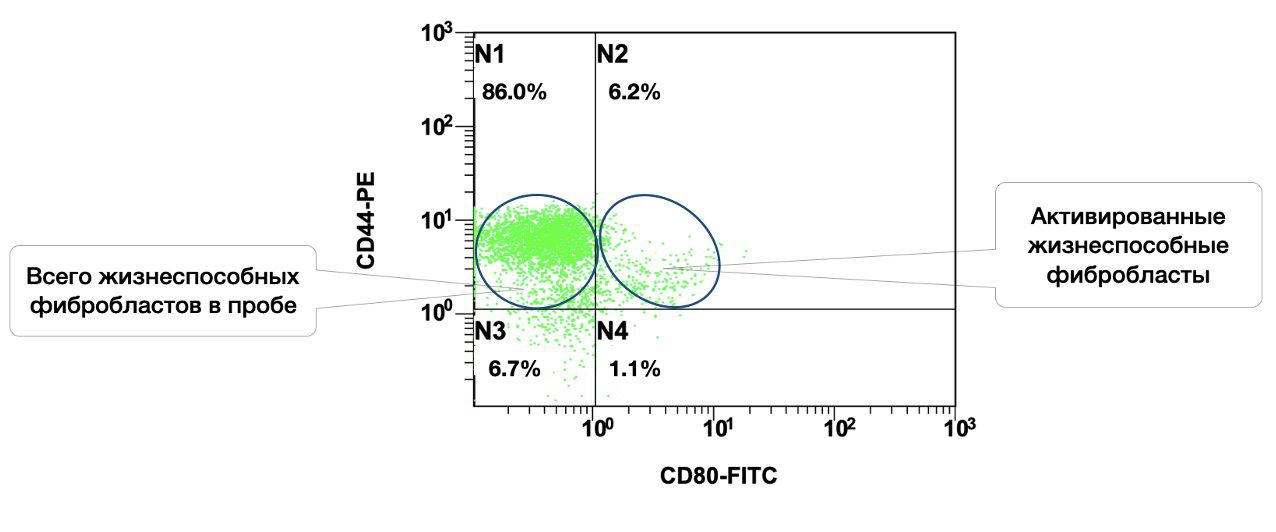
Рисунок 3.6. Соотношение относительного количества жизнеспособных фибробластов (фенотип CD45f-CD14-CD44+) и их активированных форм (фенотип CD45f-CD14-CD44+CD80+) в суспензии клеток биоптата кожи человека, полученное методом проточной цитометрии
В этом же образце кожи 78,5% жизнеспособных тучных клеток среди всех тучных клеток в пробе, но из них в состоянии активности только 1,1% (рис. 3.7 и 3.8).
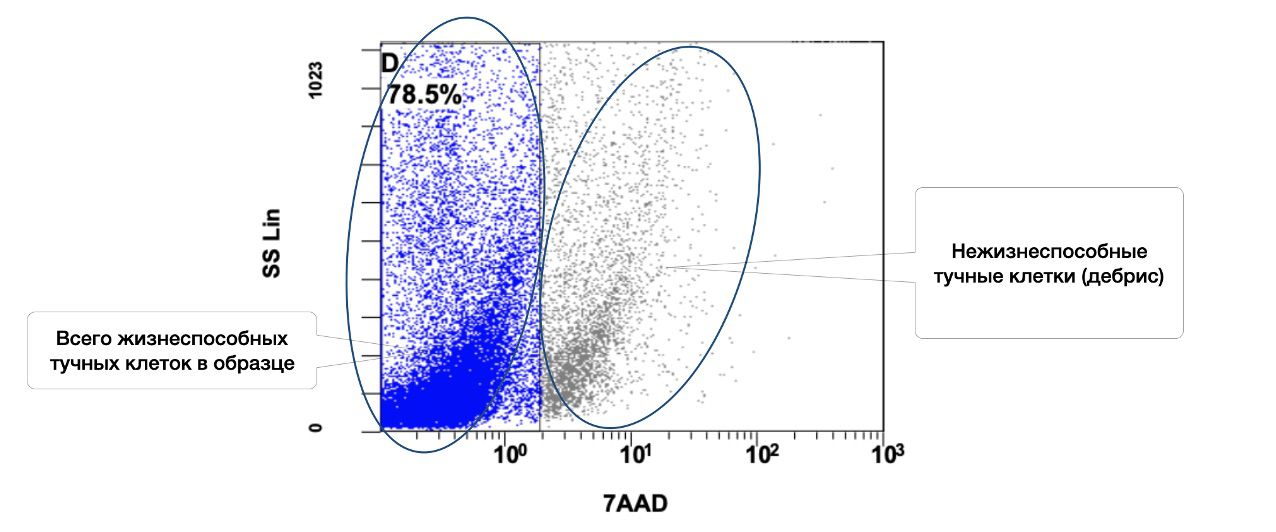
Рисунок 3.7. Относительное количество жизнеспособных (7AAD) тучных клеток (фенотип CD249+) в суспензии клеток биоптата кожи человека, полученное методом проточной цитометрии
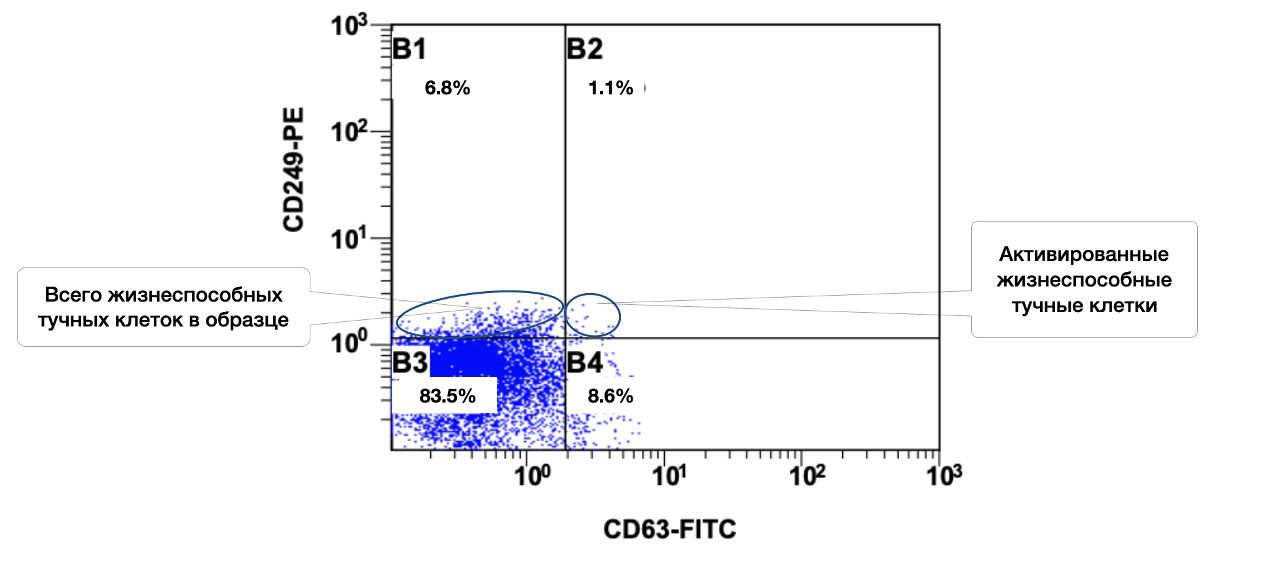
Рисунок 3.8. Соотношение относительного количества жизнеспособных тучных клеток (фенотип CD249+) и их активированных форм (фенотип CD249+CD63+) в суспензии биоптата кожи человека, полученное методом проточной цитометрии
Одновременно, в образце кожи 7% моноцитов, из них в состоянии активности 2,6% (рис. 3.9).
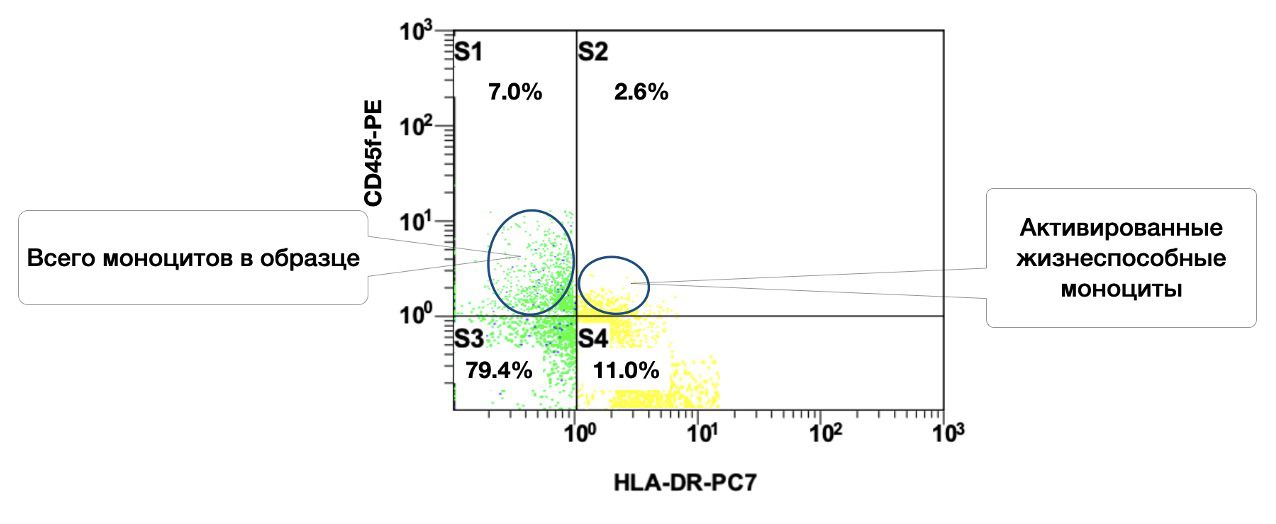
Рисунок 3.9. Соотношение относительного количества жизнеспособных моноцитов (фенотип CD45+CD14+) и их активированных форм (фенотип CD45+CD14+HLA-DR+) в суспензии биоптата кожи человека, полученное методом проточной цитометрии
Жизнеспособных внутриэпидермальных макрофагов в образце кожи 47,9%, из них в состоянии активности 4,9% (рис. 3.10).
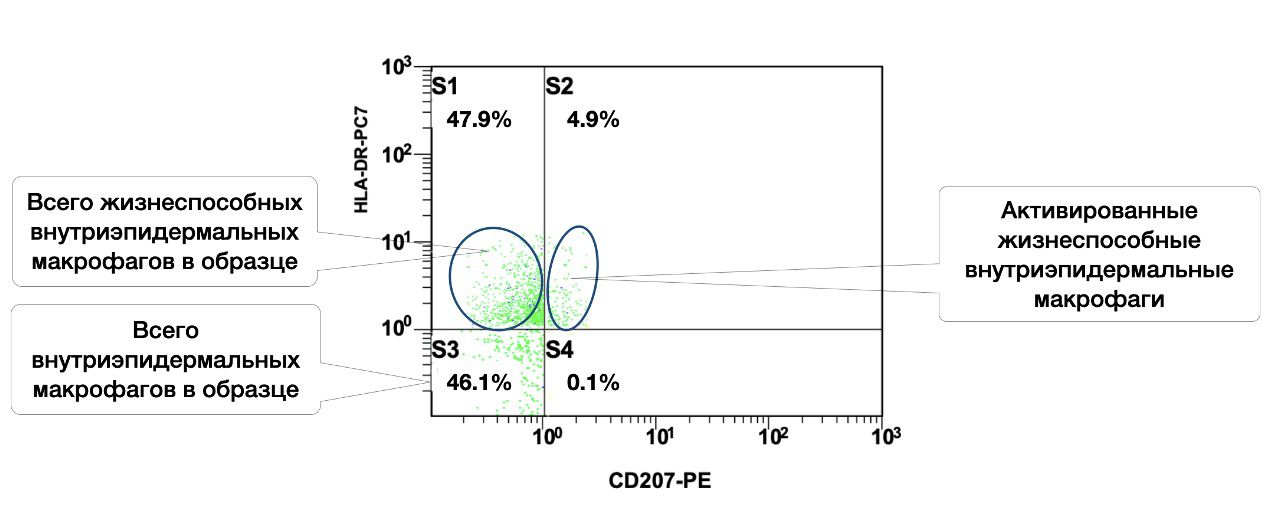
Рисунок 3.10. Соотношение относительного количества жизнеспособных внутриэпидермальных макрофагов (фенотип CD207+) и их активированных форм (фенотип CD207+HLA-DR+) в суспензии биоптата кожи человека, полученное методом проточной цитометрии
Также в данном образце кожи эндотелиальные клетки представлены в активированном состоянии 5,4 % одним и 5,9 % двумя признаками, но всего жизнеспособных эндотелиоцитов 60,3% (рис. 3.11).
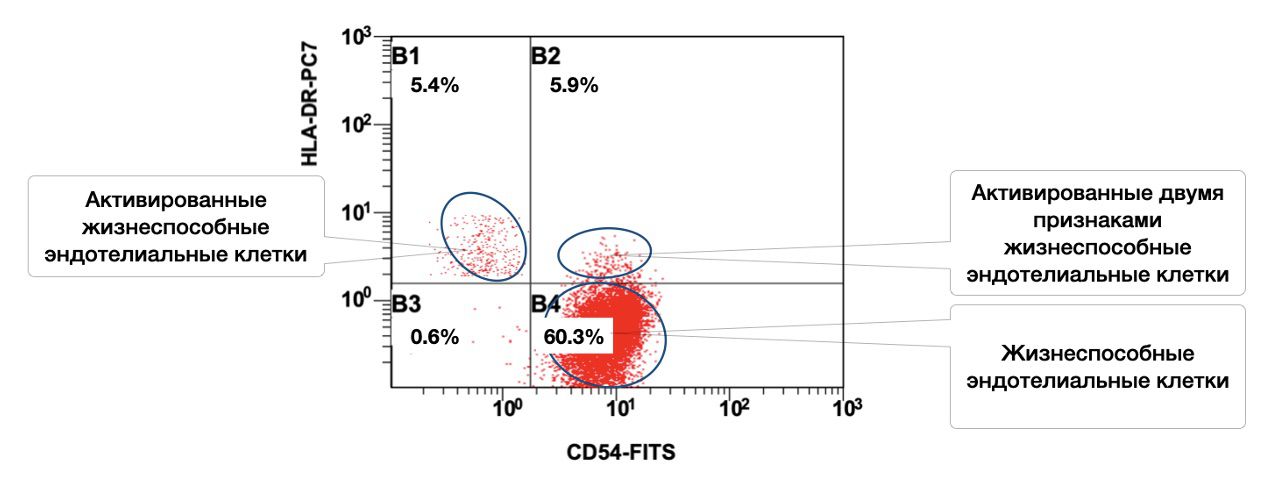
Рисунок 3.11. Соотношение относительного количества жизнеспособных эндотелиальных клеток (фенотип CD146+) и их активированных форм (фенотипы CD146+HLA-DR+; CD146+CD54+; CD146+CD54+HLA-DR+) в суспензии биоптата кожи человека, полученное методом проточной цитометрии
Общие результаты исследованной суспензии клеток выделенных субпопуляций были представлены на бланке (рис. 3.12).
Приведенные, в качестве демонстрации возможностей проточной цитометрии для прецизионной диагностики состояния кожи, результаты обследования условно здорового добровольца показывают, что в данном образце кожи:

Рисунок 3.12. Результаты цитоиммунограммы кожи на бланке
Данный пример позволяет использовать способ оценки фенотипа у более широкой выборки добровольцев с целью определения половозрастных особенностей количественно-функционального состояния клеток кожи.
У 80 здоровых добровольцев, поделенных на группы по полу и возрасту 25-45 лет и 45-65 лет, по 16 человек в каждой, был выполнен забор биоптата кожи, из которого были выделены субпопуляции клеток для фенотипирования и построения цитоиммунограмм кожи. Период наблюдения и оценки данных составил не более 1 года.
В результате, впервые из общей гетерогенной популяции клеток кожи были получены отдельные жизнеспособные субпопуляции клеток из нативного и криоконсервированного образца, определен фенотип клеток, их функциональная активность и жизнеспособность (табл. 3.1).
Таблица 3.1. Сравнительная оценка количественного и функционального состояния жизнеспособных клеток в нативных и криоконсервированных биоптатах кожи условно здоровых лиц, n=80
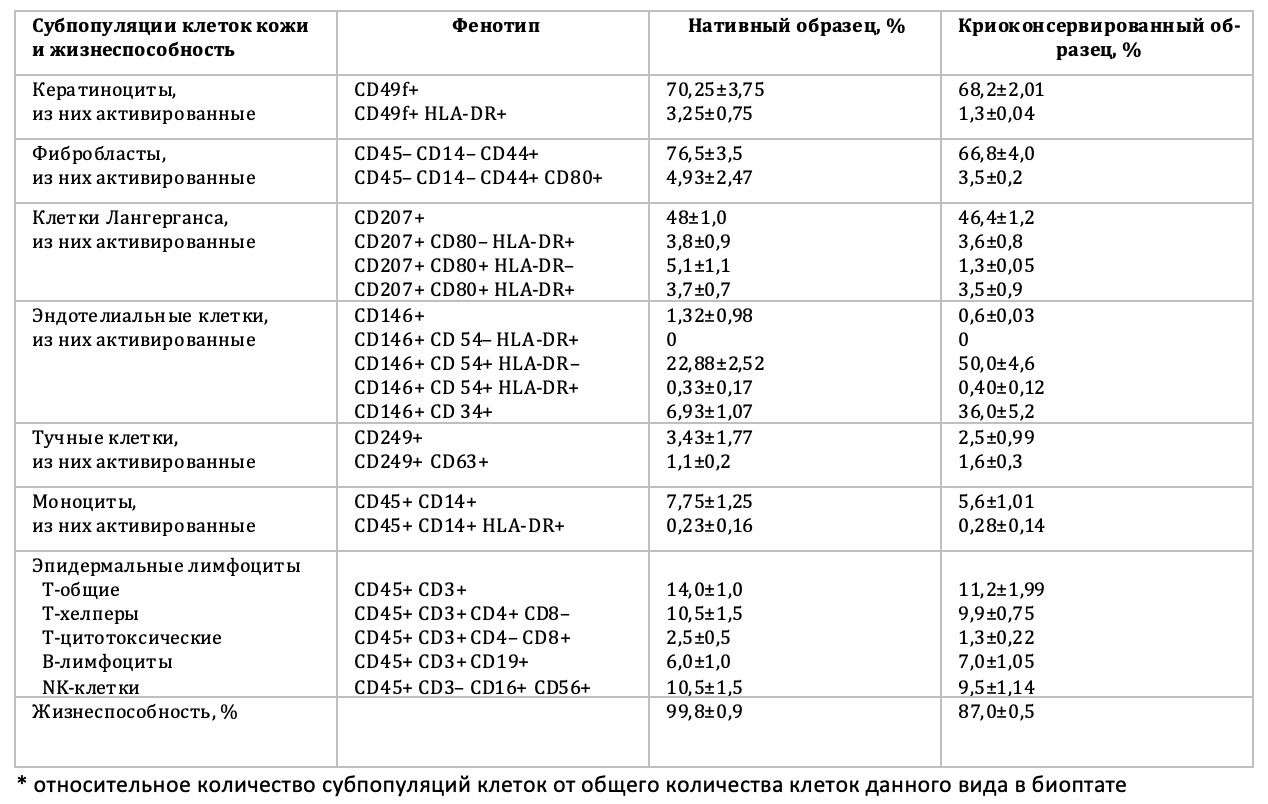
При сравнении данных процентного соотношения клеток кожи двух образцов, существенного расхождения в показателях не обнаружено. Отмечено, что жизнеспособность в нативных образцах составила – 99,8±0,9%, а после криоконсервации – 87,0%±0,5. Этот результат позволяет рекомендовать криоконсервацию в качестве способа сохранения образца для дальнейших наблюдений в динамике. Деление обследованных по полу и возрасту было необходимым, чтобы показать различие измеряемых параметров в разных половозрастных группах.
При этом, среднестатистическая характеристика (табл. 3.2) сделана для демонстрации возможностей скрининговых подходов в оценке фенотипа субпопуляций клеток кожи.
Таблица 3.2. Среднестатистическая характеристика фенотипов основных субпопуляций клеток кожи в биоптате условно здоровых лиц с распределением по полу и возрасту (n=80).
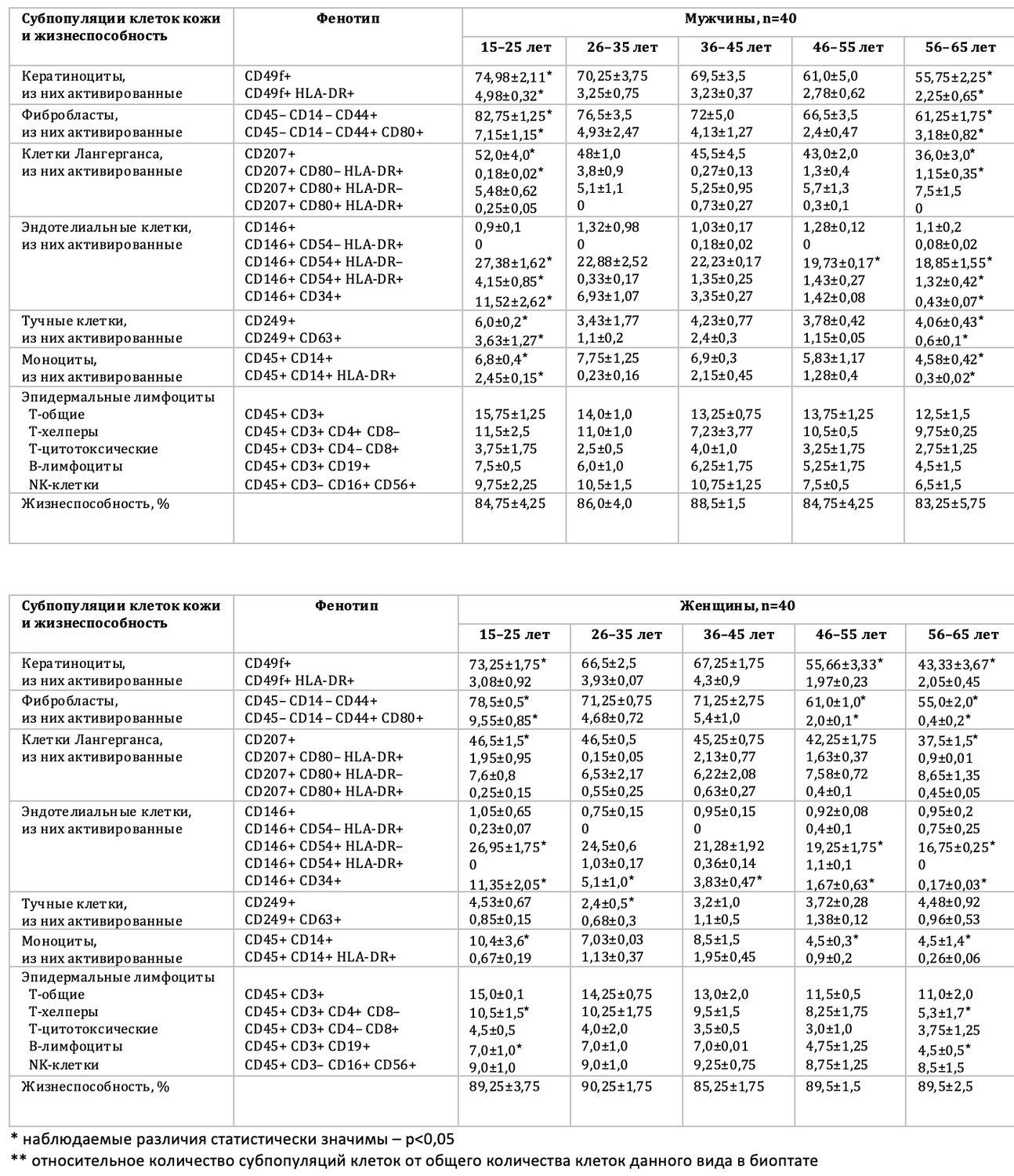
Способ получения сведений о фенотипе клеток кожи различных субпопуляций закладывает основу персонализированного подхода и может быть использован при дальнейших исследованиях кожи и её состояний, в том числе для формирования реестра нормативных показателей.
Проведенное исследование условно здоровых лиц позволило определить среднестатистические значения параметров фенотипического статуса кожи человека. Результаты, представленные в таблице, требуют уточнения, но начало положено.
Представленные результаты обнаружили, что количество кератиноцитов в эпидермисе с возрастом уменьшается. Практически каждая субпопуляция демонстрирует снижение функциональной активности с возрастом. Результаты достоверны в группах сравнения 25-45 и 45-65 у обоих полов, а также в группах сравнения 25-45 и 45-65 между мужчинами и женщинами.
Становится очевидным, что способы получения гетерогенной популяции клеток кожи человека [53] и определения субпопуляционного состава клеток кожи с оформлением цитоиммунограмм кожи [49] демонстрируют новые исследовательские возможности, которые могут быть применены для прецизионной диагностики иммуноопосредованных дерматозов.
Концептуальное обоснование применения метода проточной цитометрии для оценки фенотипического разнообразия клеток кожи человека и прецизионной диагностики иммуноопосредованных дерматозов может послужить устранению несоответствия между событиями на уровне клеток и способами их объяснения. Введение столь непривычного подхода сделано намеренно, в пользу максимальной объективности суждений. Существо подхода состоит в следующем.
1. В качестве основного инструментария анализа экспериментальных данных о состояниях и динамике клеточных субпопуляций выбрана технология, оперирующая концептами на основе строгих математических методов и позволяющая выводить логически непротиворечивые следствия из утверждений и предположений, полученных опытным путем. Основание для выбора концептуальных методов анализа следующее. Концепты используются в неразрывной взаимосвязи двух своих существенных граней: объема понятий и содержания. И поскольку клеточный уровень исследования состояний кожи напрямую выводит к исследованию структур субпопуляций клеток, образованных из различных множеств, то это дает шанс через исследование этих множеств как объемов стоящих за ними понятий выйти к содержанию данных понятий и концептуально различить все разнообразие состояний кожи;
2. Предлагается концептуализацию наблюдаемых феноменов проводить в трех предметных областях, построенных в логике углубления различения состояний кожи:
3. Выбрана тактика осмысления предметных областей. Это решение связано с тем, что результаты концептуализации одной предметной области неизбежно окажут влияние на исходные представления необходимые для постижения другой.
Для построения ряда концептов в математическом аппарате родов структур, который задействуется в концептуальных методах, приняты исходные положения, выведенные из известных свойств клеток кожи. Они могут быть обобщены в следующих утверждениях:
Эти утверждения служат основанием для создания концептов, каждый из которых определяет класс возможных феноменов и позволяет различать разнообразие ситуаций, возникающих в коже на клеточном уровне. Далее с короткими пояснениями приводятся лишь те концепты, которые определяют статичные феномены кожи. Их можно рассматривать как мгновенные «срезы» динамики ее состояний. Концепты приводятся в математическом аппарате родов структур.
Поскольку у любой клетки кожи каждого вида может проявиться любое сочетание признаков, то эта структура устанавливает полное разнообразие всех комбинаций признаков, которые только могут быть у клетки кожи любого вида. Учитывая, что каждая комбинация признаков клетки указывает на активность ее определенной функции, то эта структура выражает одновременно полное разнообразие функций, которые могут активировать клетки, независимо от их вида.
Если количество признаков каждой клетки равно Р, а по одному из них определяют вид самой клетки, то разнообразие комбинаций признаков и, следовательно, функций клеток может достигать числа 2 (Р-1)-1. Здесь учтено, что если никаких признаков клетка не проявляет (пустое подмножество признаков – ∅) , то она функционально пассивна. С учетом известного количества признаков клетки каждого вида (Р = 24) получается, что максимальная мощность гипотетического разнообразия функций одной клетки любого вида (F) составляет более 8 миллионов (конкретно: F = 8 388 607). Причем каждая из этих функций может быть различима.
С целью демонстрации возможностей метода возьмем базисное множество:
Х1 – множество признаков клетки любого вида, которые экспериментально обнаруживаются кластерами дифференцировки.
Родовое отношение будет выражено следующей структурой:
D1 ∈ B(Х1).
Тип этой структуры: «Множество всех подмножеств признаков клетки».
Пример 1.
Предположим, что у клетки не 24 признака, а всего 3.
То есть пусть множество Х1 = {a, b, c}.
Тогда комбинации из этих признаков образуются так:
В(Х1) = {{a}, {b}, {c}, {a,b}, {a,c}, {b,c}, {a,b,c}, {}}.
Выходит, что количество комбинаций равно 23. Без пустого множества, которое свидетельствует о пассивности клетки, количество «активных» комбинаций получается: 23-1.
Каждая комбинация – это функция клетки.
Стало быть, из трех признаков образуется семь комбинаций – семь функций:
{a}, {b}, {c}, {a,b}, {a,c}, {b,c}, {a,b,c},
1 2 3 4 5 6 7.
Этот результат концептуализации позволяет определять каждую функцию клетки и разрабатывать способы ее активизации или подавления.
Попробуем расширить концептуализацию, взяв к обсуждению не только признаки клеток одного вида, а множество видов клеток. В этом случае:
Х1 – множество признаков клетки любого вида, которые экспериментально обнаруживаются специальными маркерами;
Х2 – множество видов клеток кожи. Это все те отличные друг от друга клетки, которые участвуют в создании феноменов здоровья кожи.
Родовое отношение имеет следующий вид:
D2 ∈ Х2 × В(Х1). Здесь «×» – знак декартового произведения множеств.
Тип этой структуры: «Множество видов клеток и множество их функций».
Эта структура определяет все ситуации, в которых необходимо различать конкретные видовые клетки со всеми их функциями. Разнообразие таких выделяемых комбинаций – более 100 миллионов (конкретно: F = 100 663 284).
Этот концепт полезен для постановки и решения узких теоретических задач в дерматологии. Так, рассмотрение клеток с их полным набором функций позволяет исследовать особенности действия всех функций каждой видовой клетки и понять, изменит ли влияние на кожу то обстоятельство, что одна и та же функция проявится у разных видовых клеток одновременно. Исходя из того, что количество видовых клеток К = 12, а количество функций каждой видовой клетки равно F = 8 388 607, то разнообразие составов «видовые клетки с их функциями» (S) равно S = K × F = 100 663 284. Разумеется, на эмпирическое изучение свойств всех этих ситуаций понадобятся годы. Но простор для теоретических исследований открыт.
Пример 2.
Предположим, что у нас только три клетки. То есть:
Х2 = {1. 2. 3}.
А у каждой клетки (из предыдущего примера) по 7 функций:
Х1 = {{a}, {b}, {c}, {a,b}, {a,c}, {b,c}, {a,b,c}}.
Тогда количество «ситуаций», когда три клетки могут выступать с разными наборами своих функций, определяется прямым произведением:
Х2 × Х1 = 1{a}, 1{b}, 1{c}, 1{a,b}, 1{a,c}, 1{b,c}, 1{a,b,c}, 2{a}, 2{b}, 2{c}, 2{a,b}, 2{a,c}, 2{b,c}, 2{a,b,c}, 3{a}, 3{b}, 3{c}, 3{a,b}, 3{a,c}, 3{b,c}, 3{a,b,c}.
Однако здесь еще не выражены реальные ситуации, при которых в конкретной панч-биопсии кожи обнаруживаются разные по количеству составы видовых клеток. В этом смысле более конструктивным и содержательно богатым следует признать концепт с другой родовой структурой.
Базисные множества этого концепта будут следующими:
Х2 – множество видов клеток кожи;
Х3 – множество функций клеток.
Родовое отношение имеет следующий вид:
D3 ∈ В(Х2 × В(Х3)).
Тип этой структуры: «Множество подмножеств видовых клеток вместе с множеством подмножеств их функций».
Она выражает все ситуации, когда в конкретной пункционной биопсии кожи можно рассматривать отдельно друг от друга такие субпопуляции, в которые собраны клетки всех видов (или лишь нескольких) вместе с их проявившимися функциями. Разнообразие их велико, но измеримо, конкретно это 2100 663 284.
Этот концепт открывает возможность различать фенотипы с полными/неполными наборами видов клеток со всеми разнообразными активностями функций, включая и те, в которых все виды клеток одновременно проявляют все свои функции:
На основе этого концепта уже можно ставить новые классы задач на исследования ситуаций здоровья/болезни с разными составами функций при полном наборе видовых клеток и других ситуаций.
Такие ситуации, возникающие вследствие эволюции состояний клеток кожи, являются «фенотипами субпопуляций» – важным диагностическим признаком, позволяющим судить о течении процессов в коже. Под фенотипом следует понимать совокупность функционально значимых маркеров, характерных для определенных стадий дифференцировки, пролиферации, активации или апоптоза. Относительное и абсолютное количество клеток, имеющих тот или иной фенотип, как раз и является конечным результатом состояний клеток.
Но в этих концептуальных конструкциях еще не учтены обстоятельства, когда в биоптате кожи оказывается какая-то определенная доля клеток каждого вида с конкретными (разными) функциями. Это будет другой концепт, который выразит полное разнообразие фенотипов субпопуляций клеток. При этом могут быть выражены необычные теоретически возможные ситуации. Например, когда при полном разнообразии клеток всех видов среди клеток одного вида окажутся клетки с разными наборами функций. Это принудит исследователей отвечать на серии вопросов о том, каковы свойства таких фенотипов субпопуляций клеток и как это сопряжено с патологиями, являющимися предметом изучения дерматологии, как науки о коже и ее заболеваниях.
Пример 3.
Предположим, что у нас только клетки трех видов. То есть:
Х2 = {1. 2. 3}.
А у каждой клетки (из предыдущего примера) по 3 функции:
Х3 = {m, n, o}.
Тогда получится увидеть (различить) следующие ситуации:
Ситуация 1: 1m,
Ситуация 2: 1n,
Ситуация 3: 1o,
Ситуация 4: 2m,
Ситуация 5: 2n,
Ситуация 6: 2o,
Ситуация 7: 3m,
Ситуация 8: 3n,
Ситуация 9: 3o,
Ситуация 10: 1n, 1o,
Ситуация 11: 1m, 2m,
Ситуация 12: 1m, 2n, 3o,
Ситуация …: 1m, 2m, 2n, 3n, 3o,
Ситуация …: 1m, 1n, 1o, 2m, 2n, 2o, 3m, 3n, 3o.
Результаты проведенной концептуализации указывают на то, что «единицей» исследования состояний кожи становится не картина ее патологических симптомов, а особенности субпопуляции клеток ее конкретного участка. Каждая субпопуляция, состоящая из клеток одновременно всех видов, отражает специфическую функционально-клеточную структуру элементарного фрагмента кожи и представляет собой ее специфический фенотип.
Это позволяет выйти на широкий класс исследовательских задач в дерматологии, опирающейся на различия фенотипов субпопуляций клеток кожи, а переход от симптоматического подхода в лечении заболеваний кожи к фенотипическому является переходом к дерматологии нового типа – фенотипической дерматологии. В ее основание должны быть положены сведения о свойствах всех возможных фенотипов субпопуляций клеток кожи.
Таким образом, сравнение критериев диагностики при визуальном осмотре сыпи, представленных Федеральными клиническими рекомендациями (2016) с фактическими результатами цитоиммунограмм кожи из воспалительных инфильтратов у больных иммуноопосредованными заболеваниями кожи демонстрирует обоснованность оценки состояния клеток основных субпопуляций кожи у каждого отдельно взятого пациента, с его уникальным анамнезом жизни, возрастными особенностями кожи и всего организма, накопленным коморбидным фоном, особенностями иммунитета и с учетом полученного ранее лечения.
Опираясь на литературные сведения, приведенные выше о составе и функциях клеток эпидермиса и дермы, в качестве базового набора маркеров дифференцирующих субпопуляции клеток и характеризующих динамику мембранных событий этих субпопуляций, предложены: CD3, CD4, CD8, CD14, CD16, CD19, CD34, CD44, CD45, CD49, CD54, CD63, CD80, CD146, CD203c; CD207, CD249. Это решение позволило усовершенствовать метод проточной цитометрии до возможности получения оценок количественного и качественного состава отдельных субпопуляций клеток кожи для прецизионной диагностики больных иммуноопосредованными дерматозами [49].
Больная Л., 28 лет, поступила в дерматологическое отделение Тюменского ОКВД с жалобами на интенсивный кожный зуд (в том числе ночью), выраженную сухость и обильное шелушение кожи, отёчность кожи, расчесы, трещины.
Больной себя считает более 15 лет, когда в пубертатном возрасте появились первые высыпания на коже локтевых и подколенных сгибов. Диагноз атопический дерматит был установлен при первом визите. Обострения были до 3 раз в год, всегда с госпитализациями. Получала лечение топическими ГКС, эмолентами, антигистаминными препаратами, топическими ингибиторами кальциневрина. Последние 2 года атопический дерматит непрерывно рецидивирует, осложняясь эритродермией и вторичным инфицированием расчесов. Получала лечение метилпреднизолоном внутривенно с курсами антибактериальной терапии и внутривенным лазерным облучением кожи. Всегда с удовлетворительным эффектом.
Аллергологический и наследственный анамнез не отягощен. Обследование у аллерголога выявило аллергию к бытовым и эпидермальным аллергенам.
При поступлении состояние тяжёлой степени. Пациентка гипостенической конституции. Аускультативно дыхание везикулярное, хрипы не выслушиваются. ЧДД 16 в минуту. Тоны сердца ясные, ритмичные, ЧСС 76 в минуту, артериальное давление 110/70 мм рт. ст. Язык влажный, розовый. Живот мягкий, безболезненный при пальпации. Печень, селезенка не увеличены. Стул регулярный, без патологических примесей. Симптом поколачивания отрицательный с обеих сторон. Мочеиспускание безболезненное. Щитовидная железа визуально не увеличена, пальпация ее безболезненная. КТ легких без особенностей. УЗИ органов брюшной полости и щитовидной железы патологии не выявило.
Патологический процесс носит распространенный характер, представлен яркой гиперемией кожи туловища, конечностей сливного характера, до состояния эритродермии. Сопровождается отечностью кожи, трещинами в локтевых сгибах и подколенных областях, обильным мелкопластинчатым шелушением с линейными расчесами скальпирующего характера по всей поверхности кожи, даже в тех местах, где пациентка не может дотянуться руками. В области розовой каймы губ трещины и шелушение (хейлит). Визуальных признаков пиодермии нет. Индекс SCORAD – 82. Паховые лимфоузлы увеличены с обеих сторон до размера лесного ореха, при пальпации безболезненны, подвижны, мягкоэластической консистенции, другие группы лимфоузлов интактны (рис. 3.13).
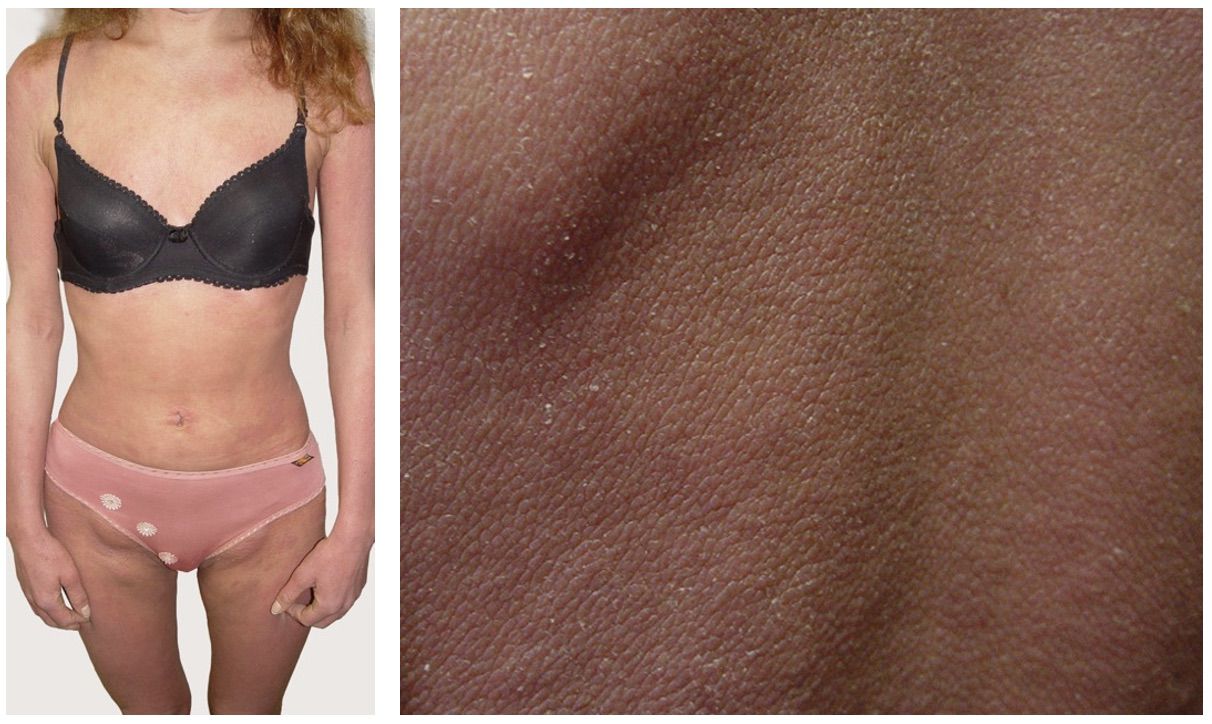
Рисунок 3.13. Клиническая демонстрация локального статуса п-ки Л., 28 лет, от 12 декабря 2014 года № 11/2
При поступлении общий анализ крови: гемоглобин – 107 г/л, СОЭ – 28 мм/ч; показатели анализа мочи в пределах нормы; показатели биохимического анализа крови в пределах нормы; гормоны щитовидной железы в пределах нормы. Анализ на гельминтозы отрицателен. Иммуноглобулины А, М, G в сыворотке крови в пределах нормы. Уровень СРБ крови – 9 мг/л. Общий IgE 5500 МЕ/мл.
На основании жалоб, анамнеза заболевания, клинической картины и результатов обследования поставлен диагноз: Атопический дерматит, эритродермия, тяжелое течение.
Согласно Федеральным клиническим рекомендациям по дерматологии (2016) «в сложных случаях при проведении дифференциального диагноза атопического дерматита проводят гистологическое исследование биоптатов кожи» [250]. У пациентки был взят биоптат кожи для оценки свойств клеток эпидермиса и дермы в очаге поражения. Учитывая, что очаг занимал всю площадь кожи, биоптат брался с верхненаружного квадранта правой ягодицы.
Таблица 3.3. Цитоиммунограмма кожи от 12 декабря 2014 года № 11/2 пациентки Л., 28 лет с диагнозом: Атопический дерматит, эритродермия, тяжелое течение
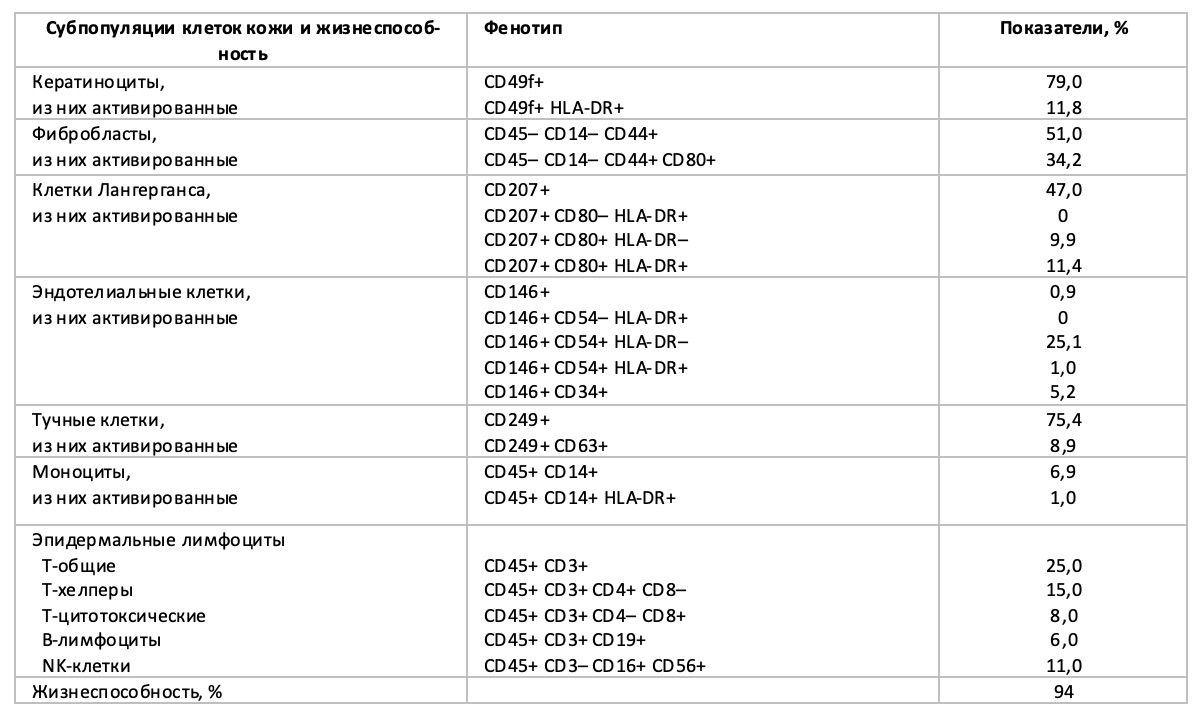
Практическое значение данного наблюдения заключается в определении начального фенотипа клеток в воспалительном инфильтрате кожи для дальнейшей оценки эффективности проводимой терапии в стационаре: метилпреднизолон 250 мг внутривенно на 200 мл физиологического раствора, №5; натрия тиосульфат 30% – 10 мл внутривенно, ежедневно, №15; кальция глюконат 10% – 10 мл внутримышечно, ежедневно, №15; пипольфен 25 мг 1 раз в сутки, 5 дне; затем тавегил 1 мг 3 раза в день, 10 дней; топическая терапия мометазона фуроатом, эмолентами и орошение расчёсов раствором хлоргексидина биглюконата 0,05%.
Клинический эффект от проводимого лечения был значительный, он проявился снижением зуда и уменьшением инфильтрации кожи.
Одновременно выявлено, что при рассмотрении субпопуляций тучных клеток кожи до лечения и спустя 1,5 месяца от начала лечения, наблюдалось фактическое снижение количества активированных форм данных клеток (фенотип CD249+CD63+) в очаге воспаления (рис 3.14.).
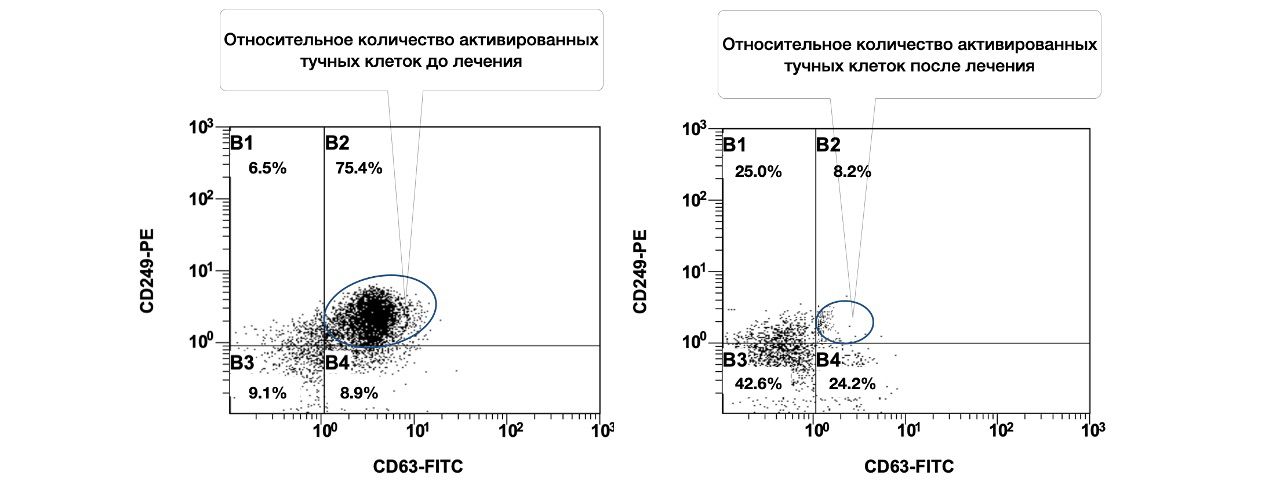
Рисунок 3.14. Сравнительная характеристика относительного количества жизнеспособных активированных тучных клеток (фенотип CD249+CD63+) в суспензии клеток биоптата кожи пациентки Л., 26 лет от 12 декабря 2014 года № 11/2 и от 25 января 2015 года № 11/5, полученная методом проточной цитометрии
Расширение возможностей проточной цитометрии до практического использования в дерматологии значительно увеличивает не только точность оценки диагностически значимых моментов, поскольку позволяет провести многопараметрический анализ клеток кожи с достоверностью только в одной пробе одного пациента, но и позволяет проводить эту оценку в динамике наблюдений. Как это было отмечено нами до лечения, через месяц и после лечения, когда наблюдалось фактическое снижение количества активированных форм фибробластов (фенотип CD45–СD14–CD44+) в очаге воспаления у данной пациентки (рис 3.15).
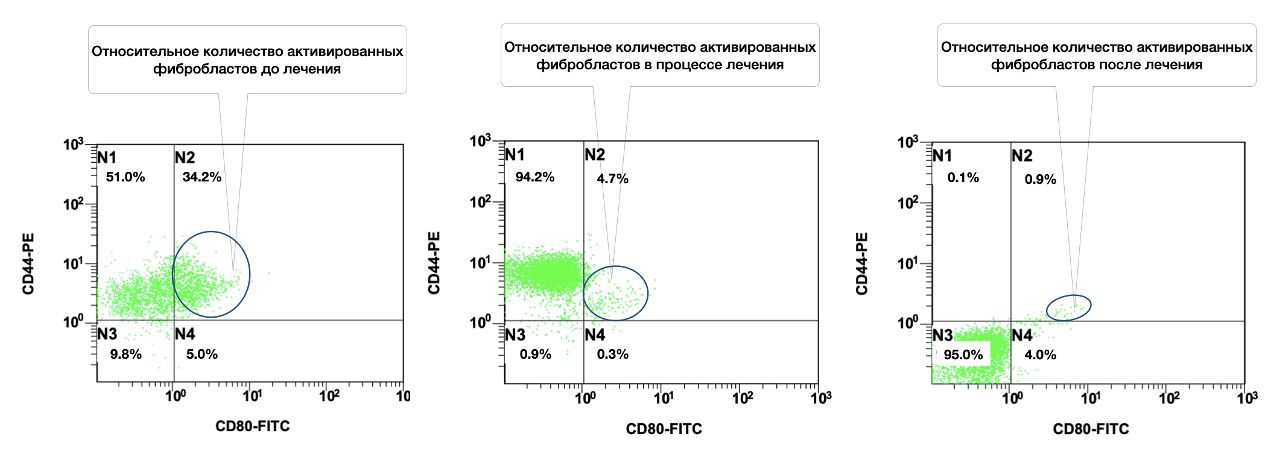
Рисунок 3.15. Сравнительная характеристика относительного количества жизнеспособных активированных фибробластов (фенотип CD45–СD14–CD44+) в суспензии клеток биоптата кожи пациентки Л., 26 лет от 12 декабря 2014 года № 11/2, от 10 января 2015 года № 11/4 и от 25 января 2015 года № 11/5, полученная методом проточной цитометрии
Например, сведения о состоянии кератиноцитов (фенотип CD49+HLA-DR+) из инфильтратов до лечения, в процессе и после лечения конкретно данной больной (рис. 3.16).
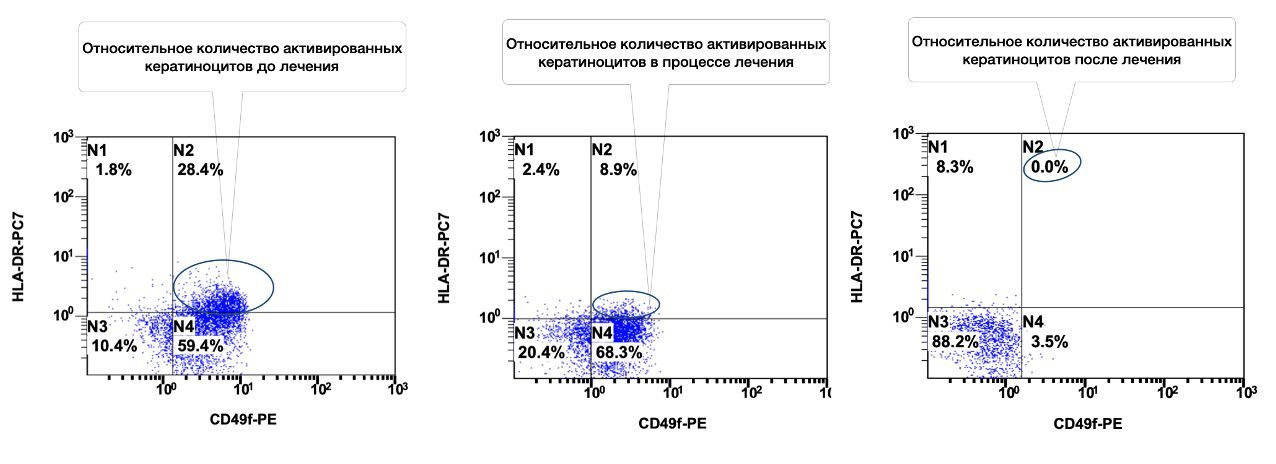
Рисунок 3.16. Сравнительная характеристика относительного количества жизнеспособных активированных кератиноцитов (фенотип CD49+HLA-DR+) в суспензии клеток биоптата кожи пациентки Л., 26 лет от 12 декабря 2014 года № 11/2, от 10 января 2015 года № 11/4 и от 25 января 2015 года № 11/5, полученная методом проточной цитометрии
Данные сведения были сопоставимы с положительной динамикой индекса SCORAD – 41 балл через месяц от начала лечения (исходно – 82) и 29 баллов спустя три недели от дня госпитализации, что как минимум, объективно свидетельствуют об эффективности проведенной терапии. Пациентка была выписана из стационара на амбулаторное долечивание.
Этим примером обосновывается использование цитоиммунограмм кожи в качестве отправной точки состояния клеток кожи воспалительного инфильтрата до лечения, в его процессе и по достижении клинической ремиссии, в качестве дополнительных (к визуальным и субъективным) критериев результативности терапии. Начало этой, более точной (выраженной в цифрах) диагностике положено, но уже сейчас оно закладывает основания для будущих подобных практических реализаций.
Таким образом, продемонстрирована эффективность применения способа оценки фенотипического состава клеток кожи у взрослых для прецизионной диагностики атопического дерматита, как одного из иммуноопосредованных дерматозов, что позволяет задуматься о совершенствовании топической терапии таких поражений кожи, как «трещины в локтевых сгибах и подколенных областях с линейными расчесами скальпирующего характера», описанные в локальном статусе пациентки при поступлении. При этом, поводов к применению разработанного способа оценки фенотипического состава клеток кожи у взрослых больных может быть гораздо больше.
Больная М., 57 лет, которая обратилась в Тюменский ОКВД с жалобами на наличие и появление пузырей на коже туловища и конечностей̆, сопровождаемых слабовыраженным зудом в вечернее время. Больной себя считает в течение полугода, когда без явной причины, заметила появление пузырьков в полости рта. Значения им не придала.
Спустя месяц, на фоне ухудшения общего самочувствия, заметила появление зуда, красных пятен и мелких пузырьков с мутным содержимым на туловище и в подмышечных областях. Самостоятельно применяла «различные мази из домашней аптечки», но новые высыпания появились на груди и спине, их размер стремительно увеличивался. Анамнез жизни, наследственный и аллергоанамнез без особенностей. Прием антибиотиков отрицает.
При обращении в поликлинику ОКВД был выставлен клинический диагноз: Пузырчатка вульгарная? Пузырчатка листовидная? Герпетиформный дерматит Дюринга?
В связи с распространенностью и тяжестью течения патологического процесса больная была госпитализирована в стационар Тюменского ОКВД, где было назначено исследование мазков-отпечатков на акантолитические клетки и проведение диагностической биопсии кожи спины (из краевой области эрозивной поверхности).
При поступлении состояние тяжёлой степени. Пациентка гиперстенической конституции. Ожирение III степени. Аускультативно дыхание везикулярное, отмечалось наличие влажных хрипов. ЧДД 20 в минуту. Тоны сердца ясные, ритмичные, ЧСС 88 в минуту, артериальное давление 140/90 мм рт. ст. Язык сухой, с белым налетом по бокам языка. Живот мягкий, безболезненный при пальпации. Печень увеличена на 2 см по нижнему краю, селезенка не увеличена. Стул не регулярный, есть склонность к запорам. Симптом поколачивания отрицательный с обеих сторон. Мочеиспускание безболезненное. Щитовидная железа визуально не увеличена, пальпация ее безболезненная.
Патологический процесс при поступлении носил распространенный характер на коже туловища, верхних и нижних конечностей, был представлен множественными округлыми, эритематозно-сквамозными очагами розового и красного цвета с редкими пятнами гиперпигментации коричневого цвета. На поверхности очагов поражения, преимущественно в области спины и груди, отмечалось наличие сгруппированных пузырьков с серозным содержимым на гиперемированном фоне, до 1 см в диаметре с плотной и напряженной покрышкой и серозным содержимым. На коже туловища, боковых поверхностей, коже ягодиц и поясницы, коже конечностей определялись сливающиеся в обширные очаги эрозии, на поверхности которых обнаруживались корочки и чешуйки. Феномен Никольского положительный. Придатки кожи в процесс не были вовлечены. В полости рта отмечено наличие эрозий и язв с белым налётом, болезненных при надавливании шпателем (рис. 3.17).
По результатам комплексного клинико-лабораторного обследования у больной был выявлен положительный мазок-отпечаток на акантолитические клетки, в периферической крови лейкоцитоз составил 14,4*109/л; лимфопения 1,19 тыс/мкл; уровень аланинаминотрансферазы 69 Ед/л; нРИФ с антителами к IgG, IgA, IgM в биоптате видимо не пораженной кожи наблюдалась выраженная фиксация IgG в межклеточных промежутках всех слоев эпидермиса, фиксации IgA и IgG в структурах кожи не обнаружено.
Эти сведения легли в основу диагноза: Пузырчатка вульгарная, тяжелая степень течения. PDAI – 190 баллов (рис. 3.17).
В условиях стационара было проведено лечение преднизолоном 100 мг в сутки (из расчета 1 мг на кг массы тела) в течение всего периода стационарного лечения – 15 дней, с последующим снижением дозы на треть сразу и титрованием по 5 мг отмены в неделю; эссенциальные фосфолипиды по 5 мл в/в струйно, №10; панангин по 1 табл. 3 раза в сутки; кальций Д3 по 1 табл. 3 раза в сутки; омепразол по 1 капс. 20 мг 2 раза в сутки; наружная терапия мазью мометазона фуроат и орошение раствором метиленового синего.
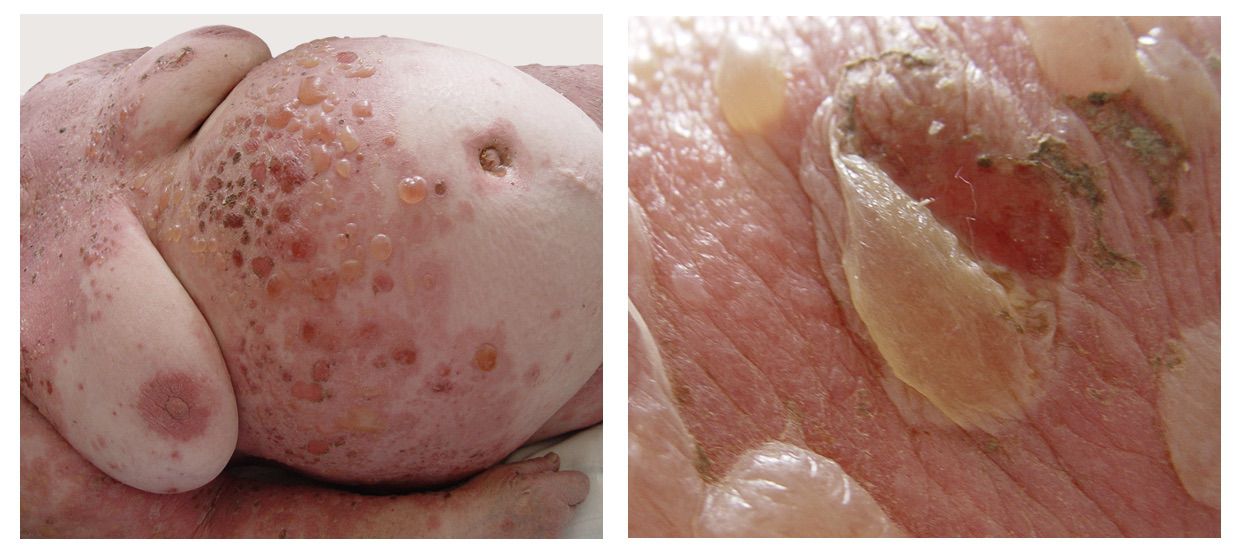
Рисунок 3.17. Клиническая демонстрация локального статуса п-ки М., 57 лет от 12 ноября 2016 года
Одновременно демонстрируются цитоиммунограмма биоптатов кожи краевой зоны эрозий (табл. 3.4).
Таблица 3.4. Цитоиммунограмма кожи больной М., 57 лет от 12 ноября 2016 года № 138/4
В представленном примере констатируется факт количественного и функционального состояния клеток основных субпопуляций кожи. Причём, у конкретной пациентки, с ее уникальными особенностями кожи и всего организма. Фактически, фотография сыпи информирует о локальном статусе, но не содержит информации о состоянии клеток, формирующих наблюдаемые элементы сыпи. Между тем «выбор метода дозы ГКС при лечении пузырчатки, – согласно рекомендациям, – зависит от степени выраженности и локализации клинических проявлений, формы и длительности заболевания, сведений об эффективности ранее проводимой терапии».
Стало быть, это зависит от субъективного и эмпирического восприятия доктора, а не от объективной количественно-функциональной характеристики клеток кожи пациента. Очевидно, это связано с тем, что наружная и системная терапия универсальны и не учитывают фактического состояния клеток кожи у одного, отдельно взятого пациента. А ведь они есть.
Так, только по одному показателю цитоиммунограммы кожи, можно проследить, что количество кератиноцитов (CD49f+) в биоптате из инфильтрата кожи больной составляло 41,2 %, из них активированных (CD49f+ HLA-DR+) 29,7 %, а после лечения согласно Федеральным клиническим рекомендациям по дерматологии (2016), 59,6 % и 37,0 соответственно (рис. 3.18)
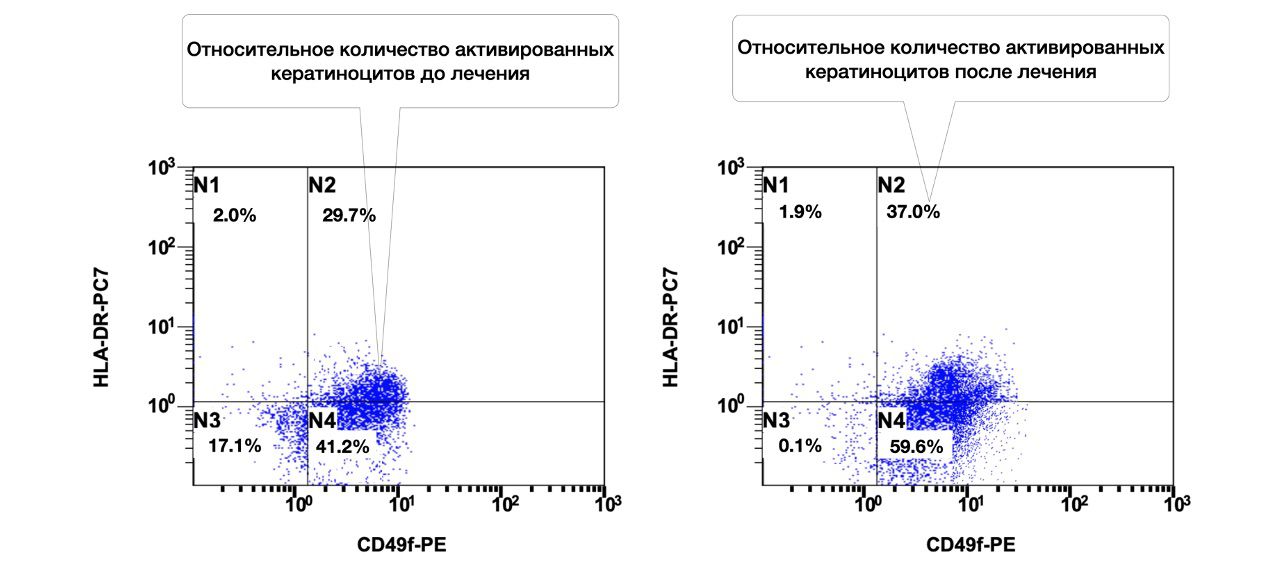
Рисунок 3.18. Сравнительная характеристика относительного количества жизнеспособных активированных кератиноцитов (фенотип CD49f+ HLA-DR+) в суспензии клеток биоптата кожи больной М., 57 лет от 12 ноября 2016 года № 138/4 и 27 ноября 2016 года № 138/5, полученная методом проточной цитометрии
Предлагаемый способ оценки получения цитоиммунограмм кожи, является не только решением важной задачи с точки зрения научных изысканий, но и позволяет дерматологу получить дополнительную объективную информацию о наличии аутоиммунного процесса в коже пациента и учитывать эти результаты как дополнительный диагностический критерий и как способ оценки эффективности проводимого лечения. Как и при большинстве других заболеваний кожи, гистологическое исследование биоптатов кожи часто проводится с целью дифференциальной диагностики. Но не для подбора лечения, что странно, ведь цитоиммунограмма кожи позволяет добавить к данному описанию еще и функциональную характеристику клеток кожи, особенно необходимую для оценки состояния кожи.
При выписке из стационара у больной отмечалась положительная динамика в виде регресса большинства высыпаний с формированием остаточной гиперпигментации. На коже туловища, верхних и нижних конечностей отмечалось наличие единичных, плотно прилегающих, сухих корок. Больная была выписана с клиническим улучшением на долечивание в амбулаторных условиях (даны рекомендации продолжить прием преднизолона в дозе 70 мг в сутки с последующим решением вопроса о снижении суточной дозы принимаемого препарата с учетом клинико-лабораторных данных и под наблюдением врача-дерматовенеролога по месту жительства. Также был рекомендован прием гепатопротекторов, ингибиторов протонного насоса, препаратов калия и магния, регулятора кальциево-фосфорного обмена.
Объективно, это сопровождалось снижением количества активированных внутриэпидермальных макрофагов (CD207+HLA-DR+) в цитоиммунограммах от 12 ноября 2016 года (начало лечения) и 27 ноября 2016 года (на момент первичного снижения дозы преднизолона со 100 мг в сутки до 70 мг. (рис. 3.19).
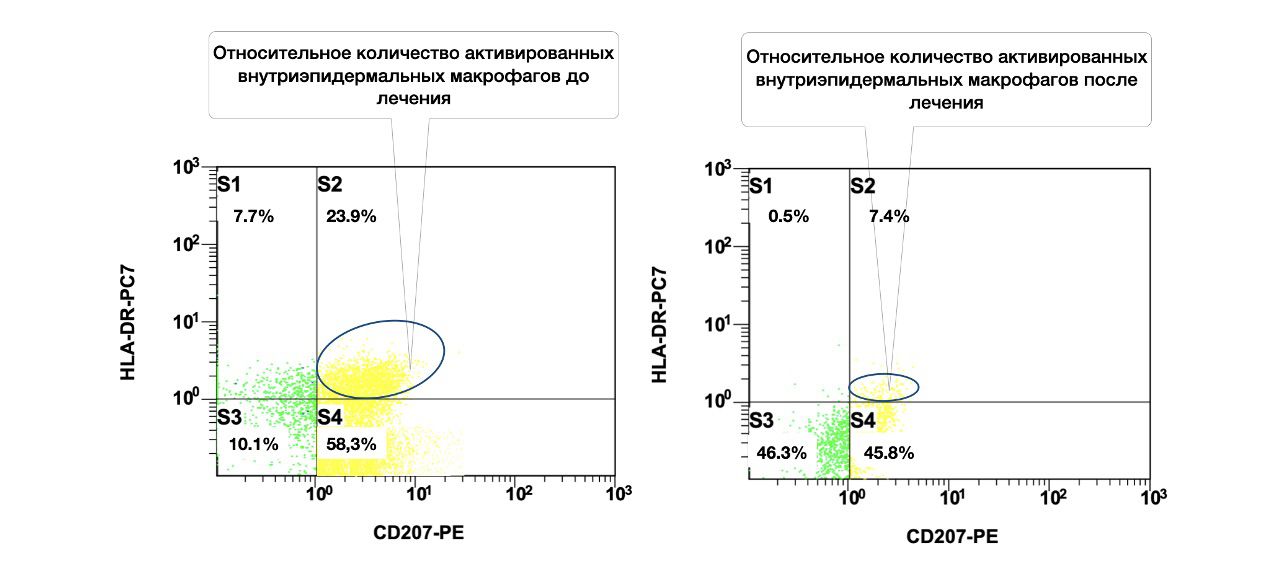
Рисунок 3.19. Сравнительная характеристика относительного количества активированных внутриэпидермальных макрофагов (фенотип CD207+HLA-DR+) в суспензии клеток биоптата кожи больной М., 57 лет от 12 ноября 2016 года № 138/4 и 27 ноября 2016 года № 138/5, полученная методом проточной цитометрии
Спустя два месяца после стационарного лечения суточная доза преднизолона была уменьшена с 70 до 30 мг в сутки. Однако, единичные эрозии сохранялись, что требовало стимуляции репаративных процессов, а в цитоиммунограмме кожи отмечался структурно-функциональный дефицит репаративного потенциала, определяемого уровнем эндотелиальных клеток, функция которых рассмотрена нами ранее (рис. 3.20).
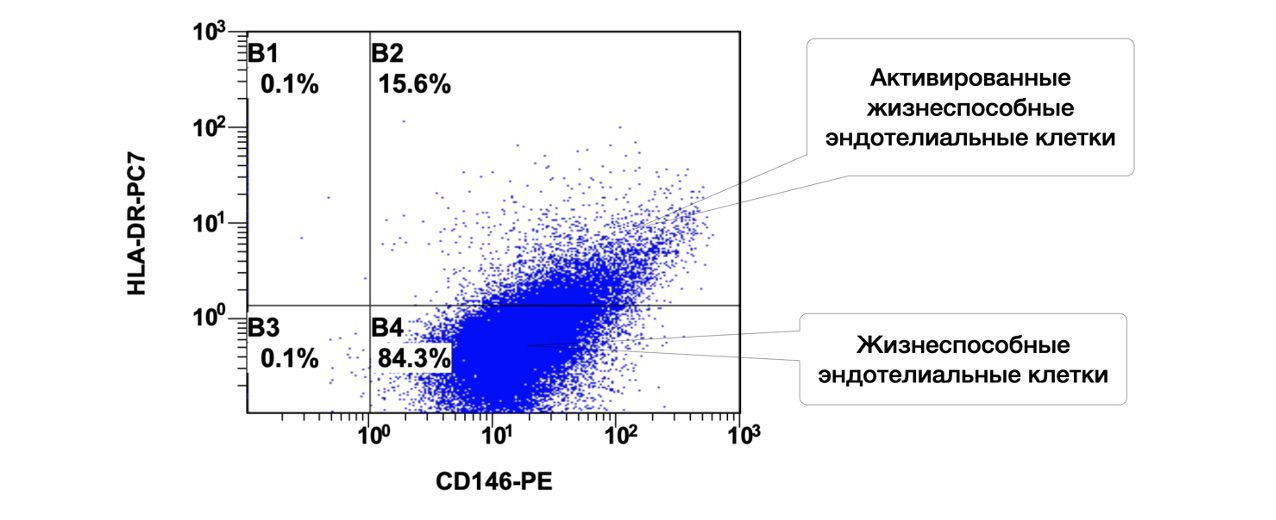
Рисунок 3.20. Сравнительная характеристика относительного количества жизнеспособных эндотелиальных клеток (фенотип CD146+HLA-DR+) в суспензии клеток биоптата кожи больной М., 57 лет от 27 ноября 2016 года № 138/5, полученная методом проточной цитометрии
Это обстоятельство может служить основанием к назначению средств с доказанным эффектом стимулирующего воздействия на пролиферацию клеток во вторую и третью фазы ранозаживления.
Таким образом, разбор данного клинического случая выявил необходимость проведения прецизионной диагностики при оказании медицинской помощи больным с тяжелой формой пузырчатки и потребность дополнения к топической терапии эрозивно-язвенных поражений кожи.