Для проведения исследований в области регенерации кожи возможно использование моделей как in vitro, так и in vivo. В коже млекопитающих преобладающими типами клеток являются фибробласты и кератиноциты [37]. В подавляющем большинстве исследований по заживлению ран in vitro используют один или оба из этих типов клеток [38].
Актуальность решения задач разработки новых способов репаративных воздействий на кожу определена постановлением Правительства Российской Федерации и приказом Минэкономразвития об обеспечении государственного контроля качества исследований парфюмерно-косметической продукции для осуществления процедуры оценки соответствия требованиям технического регламента Таможенного союза «О безопасности парфюмерно-косметической продукции» ТР ТС 009/2011 (Федеральный закон от 28.12.2013 № 412-ФЗ ред. от 23.06.2014 «Об аккредитации в национальной системе аккредитации»).
В одной из концептуальных схем, описанных ранее был выделен видовой концепт одного из фенотипов клеток кожи, по отношению к которому была поставлена задача разработки технического устройства для избирательной активации in vitro клеток кожи определенного фенотипа. С учетом результатов концептуализации решение обозначенной задачи было сформулировано так:
TR1 = {d ∈ D3 ⎜(Pr1d ∈ X2)}
В результате решения этой задачи был разработан амплификатор репаративных потенций клеток кожи – устройство для избирательной активации in vitro клеток кожи определенного фенотипа [51]. С одной стороны, это устройство – отклик на потребность внедрения в медицинскую практику экспертных систем [187]. С другой стороны – оно открывает возможность для создания ряда решений по так называемой «адресной доставке» активных веществ, перспективы которой в практической дерматологии были обозначены ранее российскими и зарубежными авторами [124; 235; 643] благодаря тому, что динамика состояний кожи может стать управляемой на уровне ее клеточного состава.
Термин «амплификация», введенный Р. Декартом в «Метафизических размышлениях» означал «усиление», но мы используем это слово в качестве имени к техническому изобретению, трактуя его как активатор репаративных потенций, коими обладает клетка кожи и, которые могут быть функционально прогрессивно проявлены.
Полезная модель амплификатора репаративных потенций относится к биотехнологиям в клеточной медицине, а именно к устройствам для работы с клетками кожи человека, создающим практическое удобство активации in vitro и внесения в рану активированных клеток кожи. Это первый практический шаг использования открывшихся возможностей изучения свойств фенотипов субпопуляций клеток кожи и целенаправленное регулирование этих свойств (активация, подавление, усиление, видоизменение и пр.) с учетом индивидуальных особенностей пациентов.
При осуществлении полезной модели поставленная задача решается за счет активации репаративных потенций клеток кожи в устройстве, содержащем емкости из непрозрачного материала в форме усеченных конусов вставляемых друг в друга, которые дополнительно имеют на боковой поверхности выступающие кольцевые буртики с симметричными фасками для герметизации, причем верхний усеченный конус заполнен активатором, верхний конец верхнего усеченного конуса закрыт плоской глухой крышкой, а его нижний торец представляет собой мембрану с равномерно распределенными отверстиями диаметром 5-7 мкм, при этом нижний усеченный конус заполнен жизнеспособной гетерогенной популяцией клеток кожи в виде суспензии. На схеме представлен общий вид устройства (рис. 3.72).
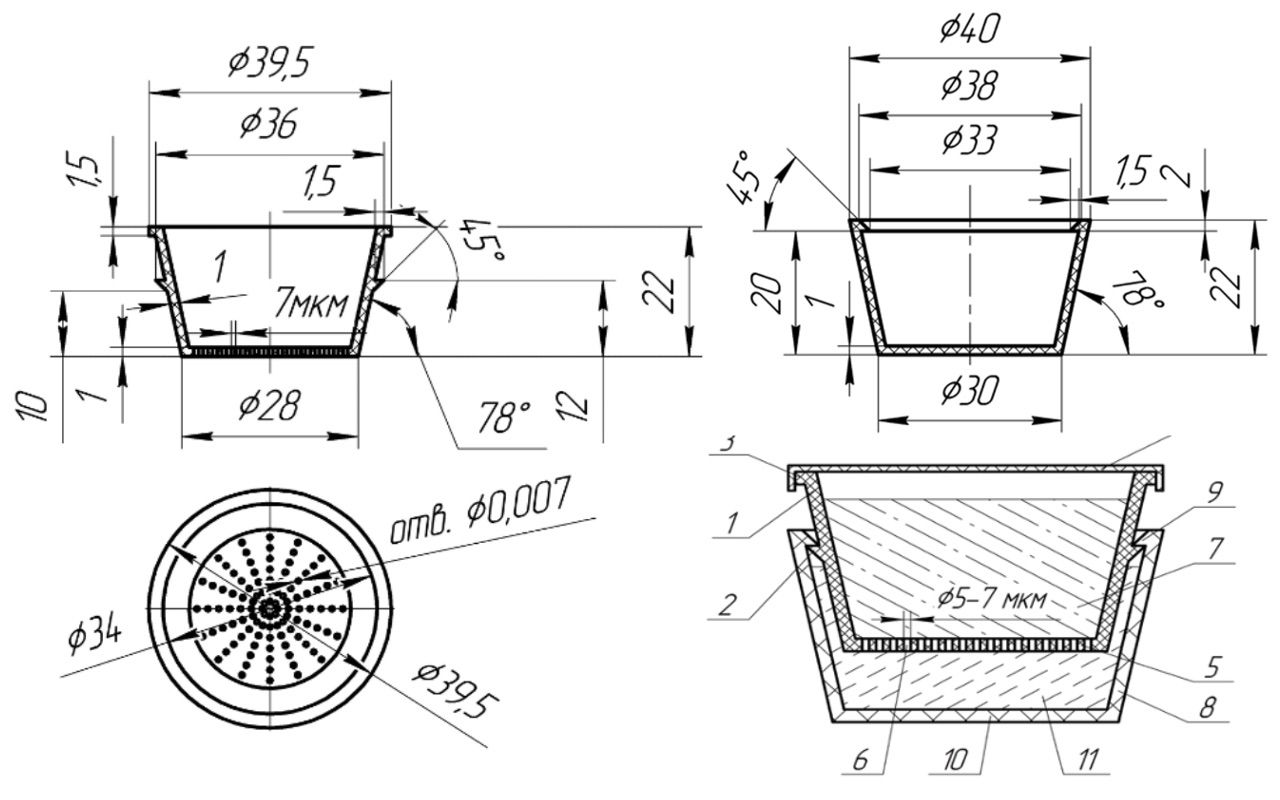
Рисунок 3.72. Схема устройства полезной модели для избирательной активации in vitro клеток кожи определенного фенотипа – амплификатор репаративных потенций.
В целом, устройство состоит из:
Герметичность соединения верхнего усеченного конуса с нижним обеспечивается выступающими кольцевыми буртиками (2 и 9) на их боковой поверхности и благодаря конусной форме емкостей в результате постоянного поджатия нижнего усеченного конуса к верхнему. При этом буртики имеют симметричные фаски для облегчения соединения усеченных конусов друг с другом. Кроме того, герметичность нижнего усеченного конуса дополнительно обеспечивается гидравлическим затвором, образованным действующим веществом в верхнем усеченном конусе, что препятствует возможному проникновению чего-либо из окружающей среды в активируемые клетки кожи (рис. 3.73).
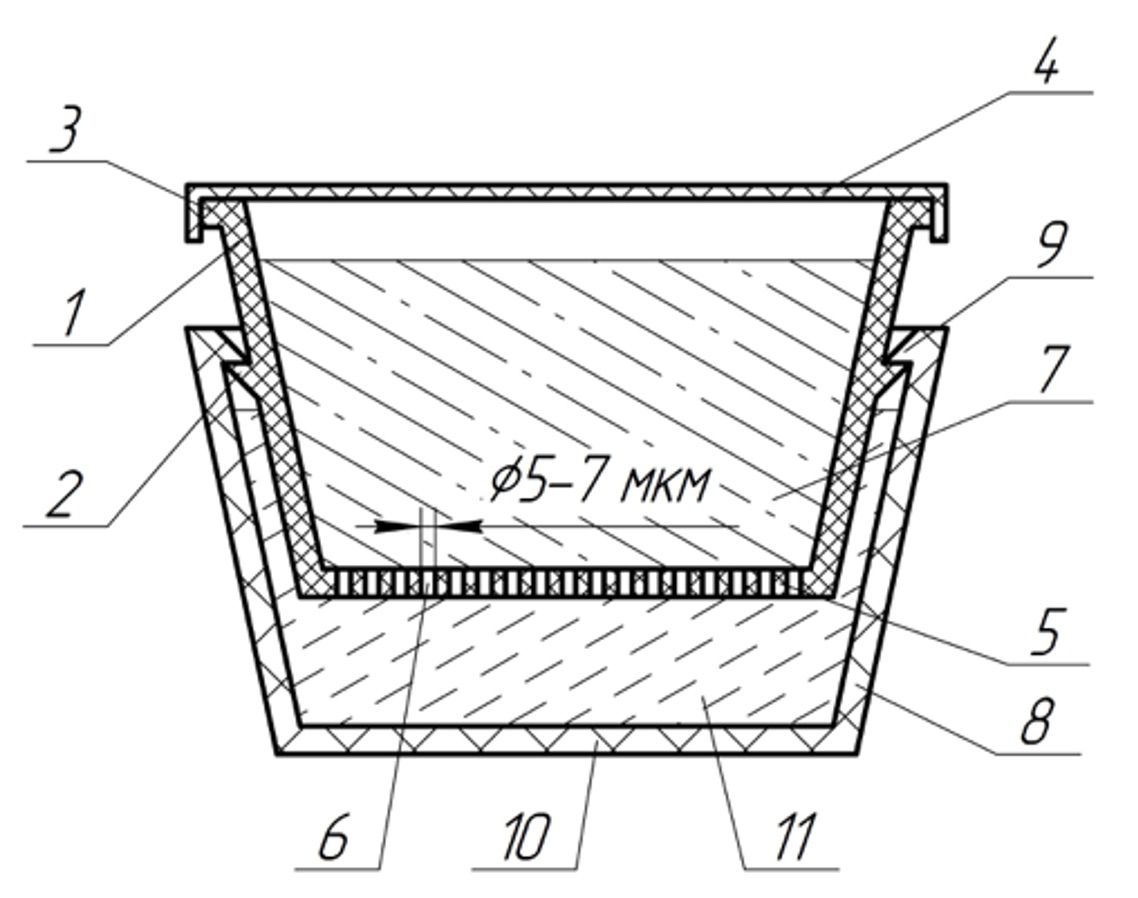
Рисунок 3.73. Кольцевые буртики устройства, обеспечивающие герметичность соединения верхнего усеченного конуса с нижним
Обеспечение ограниченного контакта активирующего вещества, которое позволяет не только культивировать клетки кожи, но и активировать их к выработке биологически активных веществ, способствующих возникновению репаративных потенций) с активируемыми клетками кожи происходит в результате размещения в верхнем усеченном конусе действующего вещества – активатора, биологически активные молекулы которого, благодаря градиенту плотности, диффундируют через мембрану с диаметром отверстий 5-7 мкм к активируемым клеткам кожи, находящимся в нижнем усеченном конусе. Диаметр отверстий в мембране выбран исходя из размеров клеток кожи, которые составляют от 8 мкм до 15 мкм, для предотвращения проникновения клеток кожи из нижнего усеченного конуса в активирующее вещество. Таким образом, часть активирующего вещества (7) оказывается погруженной в суспензию разделенной жизнеспособной гетерогенной популяции клеток кожи (11).
Для обеспечения герметичности верхний усеченный конус снабжен глухой плоской крышкой (4), представленной на рис 3.74.
Рисунок 3.74. Крышка устройства, обеспечивающая герметичность верхнего усеченного конуса
Все конструктивные элементы устройства изготавливаются из непрозрачного материала химически инертного по отношению к активирующему веществу и разделенной жизнеспособной гетерогенной популяции клеток кожи – из медицинского полипропилена (рис. 3.75).

Рисунок 3.75. Компьютерное моделирование устройства – амплификатор репаративных процессов и изготовление прототипа из медицинского полипропилена на 3D-принтере.
Устройство работает следующим образом (рис. 3.73). Первоначально верхний усеченный конус (1) заполняют активатором и фиксируют на буртике (3) глухую плоскую крышку (4) для герметизации. Нижний усеченный конус (8) заполняют разделенной жизнеспособной гетерогенной популяцией клеток кожи в виде суспензии (11). Соединяют усеченные конусы между собой, вставляя верхний усеченный конус (1) в нижний (8), до фиксации их буртиками (2 и 9). После этого, в разделенную жизнеспособную гетерогенную популяцию клеток кожи начинают диффундировать по градиенту плотности через отверстия (6) диаметром 5-7 мкм в мембране (5) верхнего усеченного конуса (1) биологически активные молекулы из действующего вещества, активируя клетки эпидермиса и дермы в суспензии (11), которые начинают вырабатывать биологически активные вещества. По истечении требуемого времени активации, отгибают буртик (9), разделяют усеченные конусы и извлекают активированные клетки кожи из нижнего конуса (8).
Учитывая необходимость накопления достаточного количества клеток в культуре, например с целью лечения ожогового больного, как правило, необходимо их субпассирование в течение нескольких недель (2-3 пересева). Чтобы клетки были способны к размножению, они должны находиться не в терминальной стадии своего развития. Столь длительное время подготовки клеток отрицательно сказывается на исходах их применения. При использовании амплификатора репаративных потенций происходит необходимое условие – быстрое (считанные часы) накопление клеточной биомассы, клетки которой активно пролиферируют и продуцируют активные вещества необходимые для репарации.
Таким образом, между заявленным техническим результатом и существенными признаками амплификатора репаративных потенций существует причинно-следственная связь, что позволяет использовать его для дальнейших исследований и развития практики.
Известно, что фибробласты и кератиноциты сохраняют способность синтезировать компоненты внеклеточного матрикса – коллаген, тропоэластин и фибронектин, а также способность удерживать гиалуроновую кислоту за счет высокого уровня экспрессии рецепторов HLA-DR и CD44+ на поверхности [78; 112].
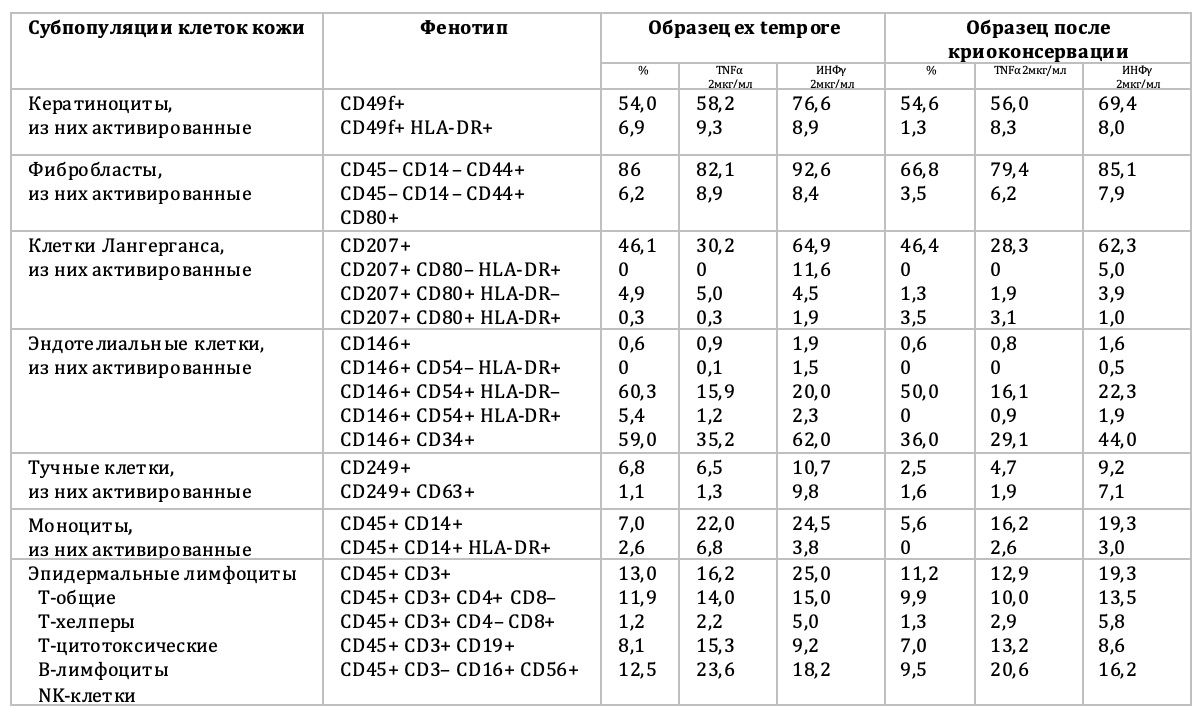
Выделение их в жизнеспособном состоянии, как объекта последующей активации, позволило не только количественно и функционально описать каждую клеточную субпопуляцию отдельно от всех других, но и в дальнейшем воздействовать на выделенные субпопуляции различными веществами, в том числе биотехнологическим средством ксеногенного происхождения, а также после криоконсервации биоптатов (табл. 3.19 и 3.20).
Таблица 3.19. Результаты активации клеток кожи человека цитокинами и биотехнологическим средством ксеногенного происхождения
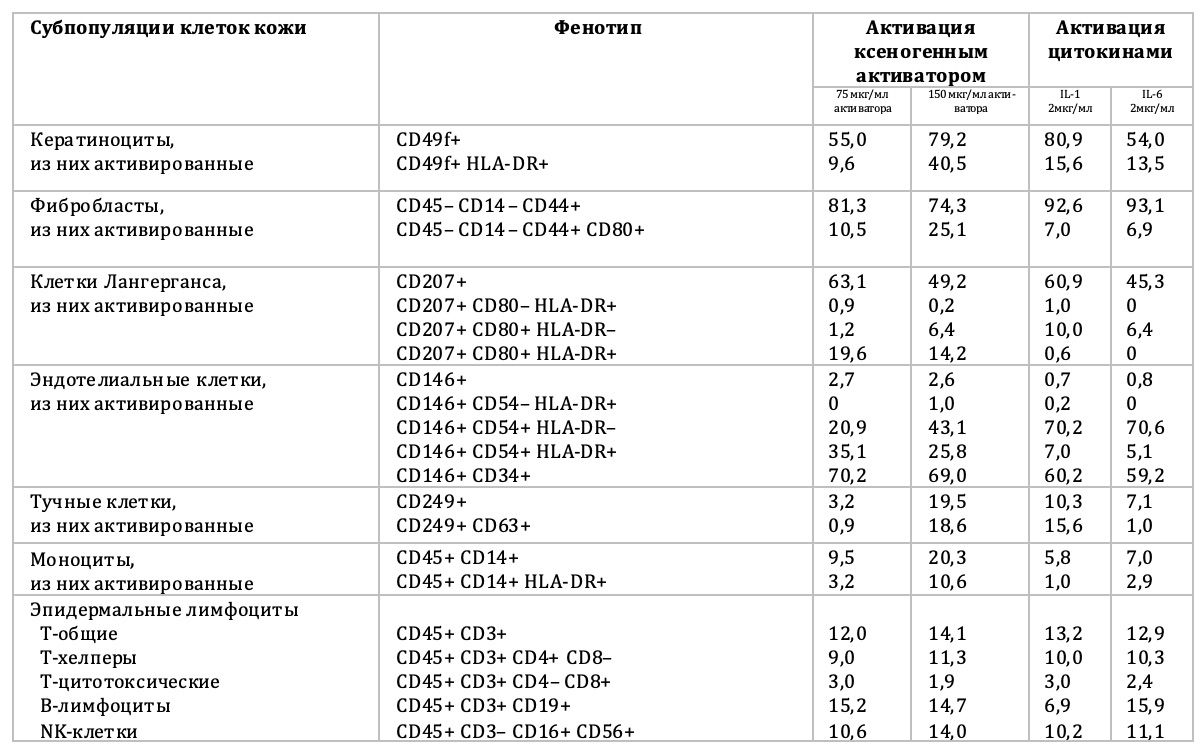
Таблица 3.20. Результаты активации клеток кожи человека TNFα и ИНФγ в нативных и криоконсервированных образцах
Полученные результаты активации позволили спланировать оценку эффективности разработанной полезной модели у больных с повреждениями кожи.
Демонстрируется пациент А., 35 лет с диагнозом: Термический ожог лица пламенем IIIА степени, S = 5%. Ожидаемые результаты от традиционного лечения: средний срок формирования грануляций при ожоговых ранах IIIА степени составляет 21 день и средний срок пребывания в стационаре пациентов с глубокими ожогами – 30-35 дней.
Лечение ожога проходило с использованием активатора репаративных потенций для ксеногенной активации аутологичных фибробластов и кератиноцитов. Работающая концентрация составила 1 миллион клеток в 1 мл (рис. 3.76 и рис. 3.77).
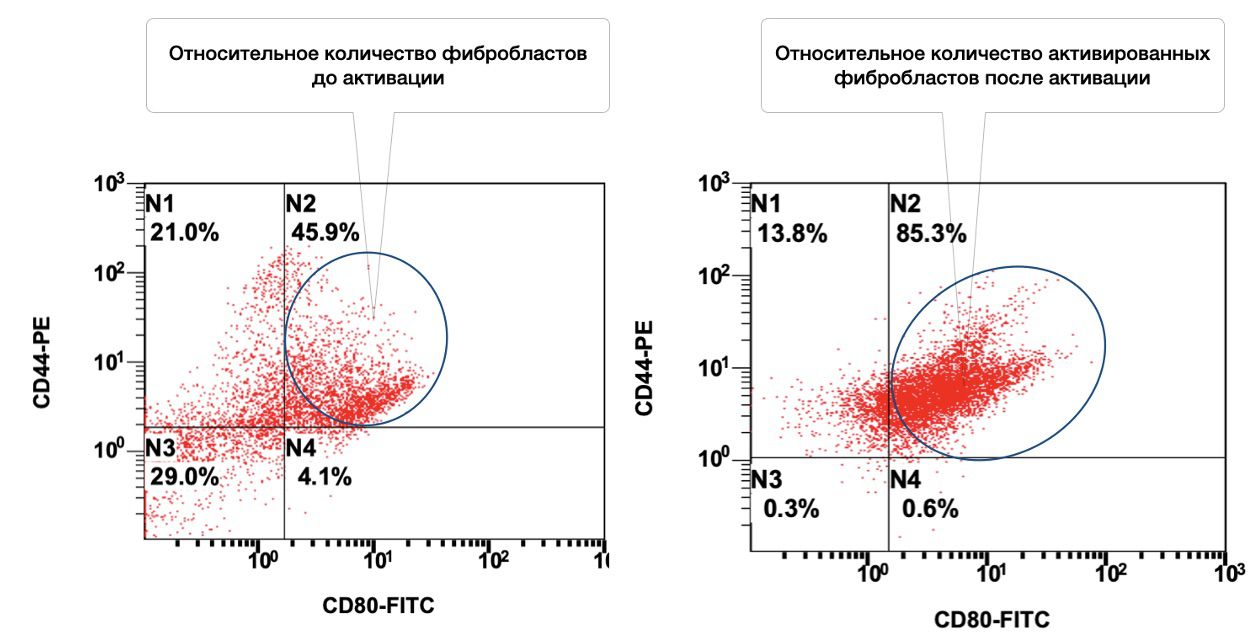
Рисунок 3.76. Сравнительная характеристика относительного количества жизнеспособных фибробластов (фенотип CD45-CD14-CD44+) до активации и после, в суспензии клеток биоптатов кожи пациента А., 35 лет с диагнозом: Термический ожог пламенем лица IIIА степени, полученная методом проточной цитометрии
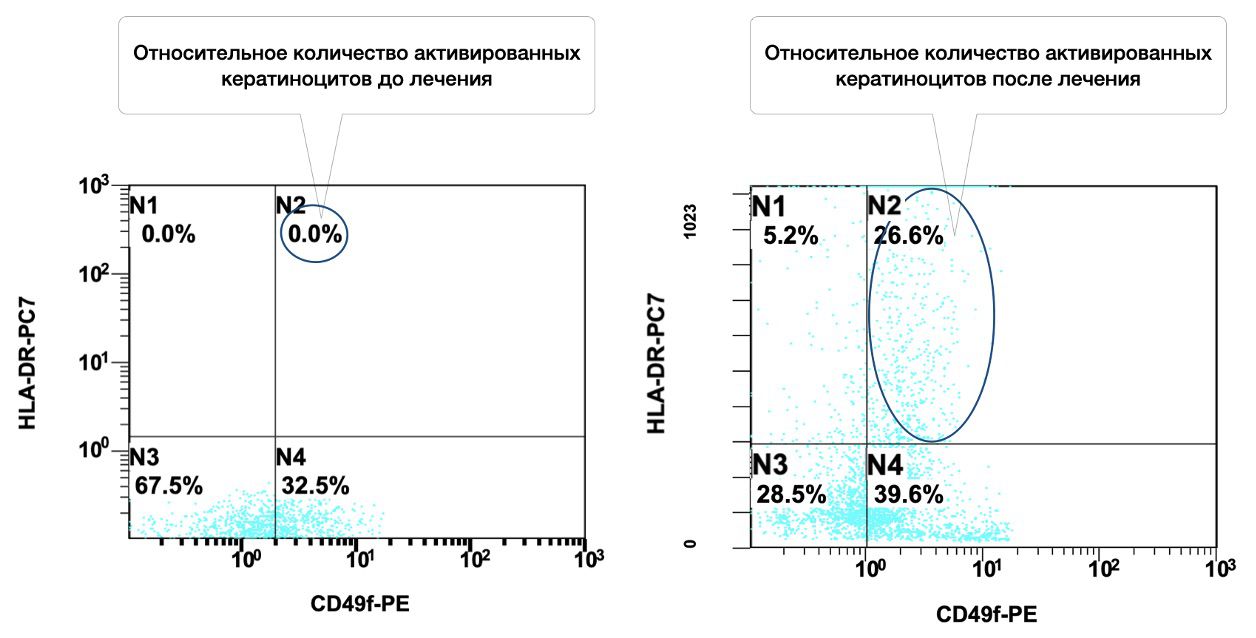
Рисунок 3.77. Сравнительная характеристика относительного количества жизнеспособных кератиноцитов (фенотип CD49f+HLA-DR+) до активации и после, в суспензии клеток биоптатов кожи пациента А., 35 лет с диагнозом: Термический ожог пламенем лица IIIА степени, полученная методом проточной цитометрии
За время лечения выполнено 25 перевязок. Учитывая локализацию, площадь и глубину поражения, после нанесения суспензии клеток, содержащей культуру активированных кератиноцитов и фибробластов, накладывались стерильные марлевые повязки, перевязки выполнялись один раз в день (рис. 3.78).
В результате лечения в области ожоговых ран сформировались яркие, сочные грануляции на 15-й день с момента травмы. Перевязки под наркозом проводились только при первой и процедуре.
Врачебным консилиумом отмечено преимущество применения активатора репаративных потенций в подготовке клеток к аутотрансплантации при лечении ожогов, а именно более короткие сроки эпителизации ран, что позволило уменьшить срок госпитализации пациента на десять дней.
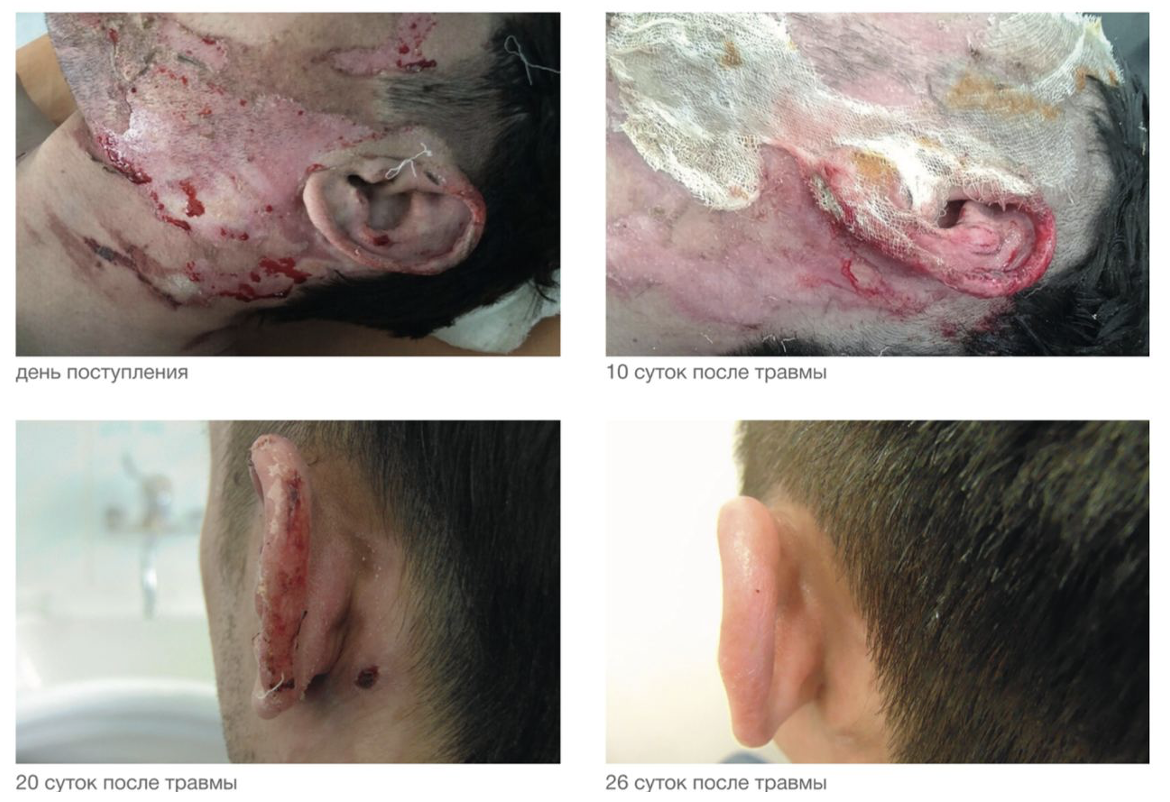
Рисунок 3.78. Клиническая эффективность применения культуры фибробластов и кератиноцитов активированных амплификатором репаративных потенций. Пациент А., 35 лет.
1. Термический ожог пламенем лица IIIА степени, S = 5%.
2. Формируется грануляционный слой (десятый день с момента травмы).
3. Грануляции сформированы и очаг эпителизирован (20-й день с момента травмы).
4. Результат заживления и восстановления (26-й день с момента травмы).