
Что определяет нашу жизнь? Конечно же новые отношения и порождаемые ими события. Но, именно смерть, своим неотвратимым пределом накладывает на нашу жизнь важное обстоятельство – жить её в максимально возможной полноте и яркости.
The history of dermatology reminds a lot of attempts to transform the dense human skin samples into a liquid phase. A search for a method aimed to separate cellular substrate of the skin and to obtain a suspension for studying the cell phenotype profile was a basis of our long-term study, which resulted in a proprietary method for digital estimation of distinct subsets composing the skin cell population. The skin cytoimmunogram is the name of the invention, which is recognized as practical and promising for implementation in public healthcare system as recognosed by the decision of the “Xth International Conference of Immunologists of the Urals”, where the report on the “Prospects for application of the skin cytoimmunogram” was presented for the first time.
The results of a single case analysis showed the following findings for this skin sample:
1) a subpopulation of keratinocytes is actively represented, most of them activated, which indicates a moderate proliferative activity of the basal layer of the epidermis;
2) there are B-lymphocytes, which normally are residents of the circulating blood and lymph, since they have a positive taxis to the high endothelial venulas located mainly in the lymph nodes. Their presence in the skin indicates the activity of humoral immunity;
3) presence of several T-cell types of (CD3+ lymphocytes) localized predominantly in the three outer layers of the epidermis, and the findings of CD4+ cells predominating over CD8+ cells suggests an increase in adaptive skin immunity;
4) low content of T-cytotoxic cells indicates to absence of an infectious/inflammatory process;
5) the remaining parameters reflect the numbers of specific skin cells, characterized by low activation grade, which, along with absence of specific complaints in this patient, indicates to normal state of his skin;
6) cell viability in the native sample was 99.8%, after cryopreservation – 87.0%.
The proposed method allows to obtain information on the quantitative composition and functional activity of skin cells, which distinctly indicates to the present condition of the patient’s local immunity and may become a basis for development of personalized curative and prophylactic programs. The Сytoimmunogram of skin as a way of skin diagnostic evaluation, is easy to implement, and it is available for qualitative and quantitative evaluation of separate cell subpopulations, in order to assess their function and degree of their response to any external or internal environmental impact. Widespread application of the сytoimmunogram perspective will allow to create sex- and age-matched registry for skin parameters in normal and pathological conditions, thus determining the extent of skin response to environmental exposures, to measure activities of cell subsets in native skin under normal and pathological conditions, to justify the criteria of age-related skin changes, to objectively assess clinical course of skin diseases, and to individually select the drug and monitor the effectiveness of external medical drugs applied.
Keywords: skin, cells, phenotype, phenotipic dermatology, cytoimmunogram, flow cytometry, cryoconservation
Сегодня нет никаких сомнений в том, что развитие науки связано с новыми технологиями, которые интегрируются в самые сложные формы деятельности человека, в том числе медицинскую науку и ее отдельный сегмент – дерматологию, как науку, изучающую кожу.
Образуя обширную область контакта с внешней средой и представляя собой важнейшую барьерную ткань, ограничивающую внутреннюю среду организма, кожа человека исторически сформировалась в самостоятельный орган иммунной системы, зачастую являясь плацдармом реализации ее механизмов реагирования. Кроме того, обладая многообразием иммуннокомпетентных клеток, кооперирующихся между собой как с помощью комплементарных структур на поверхности, так и при участии иммунорегуляторных цитокинов, организация кожи позволяет ей участвовать в иммунных реакциях всего организма, при этом осуществляя некоторые иммунологические процессы самостоятельно, in situ.
Клеточный субстрат иммунной компетентности кожи представлен резидентными и рециркулирующими клетками костномозгового происхождения. К резидентным клеткам относятся тучные клетки, клетки Лангерганса, кератиноциты, эндотелиальные клетки, фибробласты, моноциты (макрофаги). Рециркулирующими являются лимфоциты и гранулоциты, причем есть мнение, что лишь определенные типы лимфоцитов способны поселяться в коже. Следует отметить, что первым концепцию лимфоидной ткани, ассоциированной с кожей (SALT – от Skin-Associated Lymphoid Tissue), сформулировал J.W. Streinlein, который объединил этим понятием эпидермис, тропные к нему T-лимфоциты, сами кератино- циты, а также дренирующие эпидермис лимфатические узлы [3].
Однако ранее к иммунной подсистеме кожи доказательно относили иммунологически значимые клетки, локализованные, главным образом, в дерме – тучные клетки, макрофаги, гранулоциты, эндотелий кровеносных и лимфатических сосудов и др. [4].
Приняв тот факт, что кожа представляет собой активный иммунный орган, так как резидентные и рециркулирующие клетки эпидермиса и дермы способны не только инициировать иммунные процессы, участвовать в них, но и определять состояние кожных покровов, это может быть оценено в ходе осмотра [6, 7].
Визуально состояние кожных покровов может оценить любой человек, основываясь на собственных знаниях. Оценка врача более точна, по сравнению с обывателем, но она все же субъективна и зависит от опыта, стажа работы, количества пациентов. В связи с этим актуализируется потребность в методах оценки состояния кожных покровов. Сегодня для этого используется ряд методов определения функций и свойств кожи. Они безопасны, безболезненны, комфортны и дают возможность многократного проведения процедуры обследования и анализа. К таковым методам относятся: корнеометрия, себуметрия, кутометрия, профилометрия [1]. Кроме того, для оценки внутренних структур кожи применяют инвазивные (гистология) и неинвазивные (оптическая когерентная томография, ультразвуковая микроскопия, магнитно-резонансная томография) методы [5].
Однако существенным их недостатком является дороговизна, недоступность, а также невоз- можность оценить клеточный состав кожи и ее функциональность [8]. Перечисленные методы, описывая ряд свойств кожи, не учитывают того, что кожа – экзоорган, на который постоянно действует окружающая среда и в котором постоянно происходит сложный комплекс межклеточных взаимодействий [9].
При этом на протяжении всего периода изучения кожи было и остается актуальным изучение фенотипа клеток ее составляющих.
Актуальным остается изучение роли хемокинов и соответствующих им хемокиновых рецепторов в патогенезе хронических заболеваний кожи [2]. Но сложность исследований обусловлена прочными десмосомальными связями клеток, препятствующими их разделению и изучению в живом виде и по отдельности.
Мы говорим о коже как о целостном органе, но состоящем из множеств и подмножеств клеток, выполняющих соответствующие их предназначению функции, понимание значения каждой из которых возможно только при определении вне отношений с другими клетками. Если бы это было возможным, то такие врачебные специальности, как дерматология и косметология, получили бы ответы на вопросы: возможна ли объективная оценка динамики заболевания кожи и как оценить степень реагирования кожи на воздействия среды, какова функциональная активность клеточных субпопуляций кожи в условиях нормы и патологии и каковы критерии возрастных изменений кожи, насколько эффективно применяемое наружное лекарственное средство и возможен ли строго индивидуальный подбор лекарственного препарата для наружного применения или косметики?
История дерматологии помнит массу попыток преобразовать кожу человека – плотную ткань в жидкость.
Поиск способа разделения клеточного субстрата кожи для получения суспензии и изучения фенотипа клеток, входящих в ее состав, стал основой многолетнего исследования, результатом которого явился патентованный способ цифровой оценки субпопуляционного состава клеток кожи – цитоиммунограмма кожи (Патент на изобретение No 2630607 от 11.09.2017).
Именно так называется изобретение, признанное практикоориентированным и перспективным для внедрения в систему общественного здравоох- ранения резолюцией «Х международной конференции иммунологов Урала», на которой впервые был представлен доклад о «Перспективах применения цитоиммунограммы кожи».
Изобретение относится к биологии и медицине и может быть использовано для определения субпопуляционного состава клеток кожи и получения цитоиммунограммы кожи. Общеизвестно, что клетки кожи соединены друг с другом десятками, сотнями, а может и тысячами отростков, крепко-накрепко спаивающих клетки в плотный конгломерат, и разделение их для помещения в жидкость, влечет разрыв мембран и грозит клеткам гибелью. Но для определения функции клетки исследователям нужны живые и только живые клетки.
Удалось создать такие условия, при которых клетки кожи, разделенные между собой и приведенные в состояние суспензии, остаются жизнеспособными на 90-99%.
А, следовательно, суспензию клеток кожи можно изучать (качественно, количественно), тестировать in vitro эффективность различных лекарственных препаратов, а в условиях криобанка еще и хранить весь субпопуляционный состав клеток индивидуального образца.
Указанный технический результат достигается способом определения субпопуляционного состава клеток кожи и получения цитоиммунограммы кожи, включающим в себя забор биоптата кожи на глубину 2 мм, гомогенизацию ткани в 0,9% водном растворе хлорида натрия при температуре +23 ... +25 °С, извлечение гомогената, фильтрование гомогената через инертную фильтровальную перегородку с диаметром пор 20 мкм, центрифугирование гомогената при 400 g в течение 5 минут при температуре +23 ... +25 °С, определение жизнеспособности клеток кожи, инкубирование в течение 20 минут в защищенном от света месте клеток кожи с моноклональными антителами, конъюгированными с флюорохромами, фенотипирование клеток кожи, определение количества клеток кожи определенного фенотипа.
Жизнеспособность клеток определяют методом проточной цитометрии с помощью внутриклеточного красителя 7-amino-actinomycin D RUO (7AAD). Идентификацию жизнеспособных клеток выполняют путем регистрации двух параметров: бокового светорассеяния (side scatter) и регистрацией флюоресценции по 3 каналу (FL3). Если не определить жизнеспособность клеток кожи, то полученные результаты окажутся менее точными, т.к. некоторые клетки разрушаются.
Полученный образец кожи можно исследовать ex tempora (сразу после забора материала) либо после длительной криоконсервации. Для этого проверенный на стерильность образец помещают в криопробирку Costar 2 мл с раствором для замораживания (90% Fetal Bovine Serum и 10% DMSO в качестве криопротектора), затем образец замораживают в парах жидкого азота t°-140°C со скоростью 1°C в минуту методом витрификации.
Инкубирование клеток кожи проводят в течение 20 минут в защищенном от света месте с моноклональными антителами, конъюгированными с флюорохромами флюоресцеинизотиоцианатом (FITC), фикоэритрином (РЕ), PE – Texasred (ESD), PE/CY5(PC5), PE/CY7(PC7) (Beckman Сoulter, США). Фенотипирование клеток кожи проводили с помощью специфиче- ских маркеров: CD3, CD4, CD8, CD14, CD16, CD19, CD34, CD44, CD45, CD49, CD54, CD63, CD80, CD146, CD203c; CD207, CD249. Выбор типа и количества флюоресцентных красителей может определяться задачей конкретного исследования. В нашем исследовании выделение субпопуляций клеток кожи было обусловлено выбором наиболее влияющих на патогенез часто встречаемых дерматозов. Так, определялись:
Продолжительность инкубирования 20 минут является оптимальной для данного способа. Попадание света во время инкубирования недопустимо, т.к. приведет к разрушению флюорохромов.
В процессе дифференцировки клеток на их поверхности появляются специфические мембранные молекулы. Такие молекулы обнаруживают с использованием набора специфических моноклональных антител, с помощью которых идентифицируют субпопуляции клеток и определяют их фенотип.
Методом проточной цитометрии определяют количество клеток кожи определенного фенотипа, используя моноклональные антитела, меченные флюорохромами и связывающиеся с определенными рецепторами на мембране клетки.
Для регистрации получаемых результатов и удобства пользования разработан бланк медицинского документа «Цитоиммунограмма кожи», в верхней части которого свободные участки для заполнения лаборантом идентификационного номера цитоиммунограммы кожи с датой проведения анализа, фамилии имени отчества пациента и его возраста.
В средней части документа в две колонки представлен состав клеток кожи с указанием фенотипа каждой популяции. Напротив каждой группы клеток кожи предусмотрены пустые поля в виде сдвоенных прямоугольников для заполнения лаборантом числовых данных в относительных и/или абсолютных единицах по результатам исследования. Представленные числовые данные указывают количество клеток кожи определенного фенотипа.
В нижней части документа имеются свободные участки, предназначенные для заполнения врачом информации о результатах исследования фенотипа клеток кожи, которые могут свидетельствовать о динамической оценке течения заболевания, эффективности использования назначенных лекарственных или косметических средств, оценке возрастных изменений кожи, индивидуальном подборе лекарственных препаратов, оценке степени реагирования клеток кожи на те или иные воздействия. А также заполняются лаборантом в свободные участки сведения об исполнителе и враче, направившем на проведение анализа.
В качестве примеров применения цитоиммунограммы кожи представляем три наблюдения предлагаемого способа оценки.
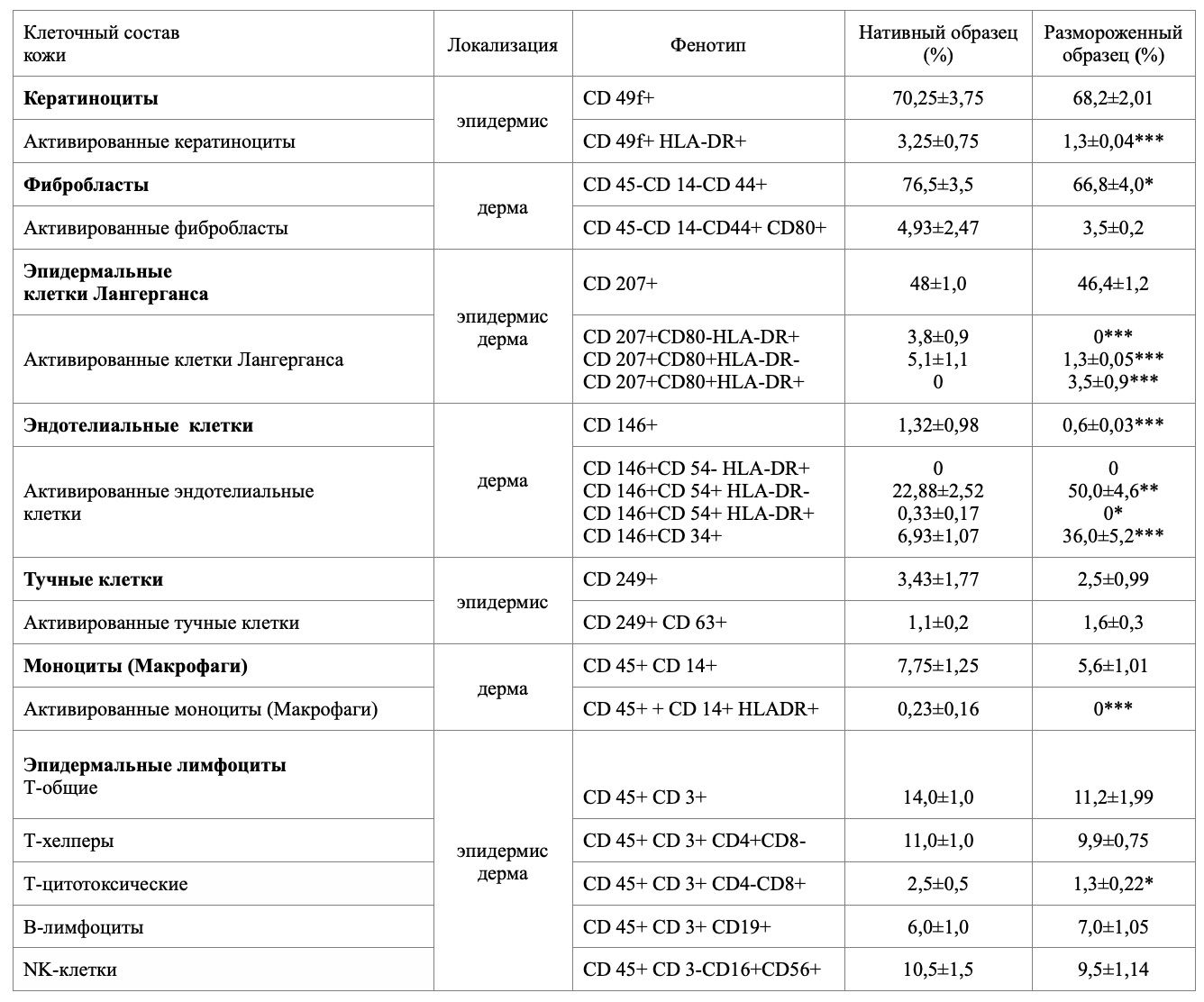
С помощью инструмента для биопсии мы осуществили забор биоптата кожи человека с ягодичной области. После пробоподготовки, описанной выше, методом проточной цитометрии на Cytomics FC500 (Beckman Сoulter, США) определяли количество клеток кожи определенных фенотипов, используя моноклональные антитела, меченные флюорохромами и связывющиеся с определенными рецепторами на мембране клетки. Результаты фиксировали на бланке (рис. 1).

Приведенные в качестве примера результаты исследования одного частного случая показывают, что в данном образце кожи:
Для демонстрации возможностей использования цитоиммунограммы кожи нами было отобрано 64 человек, которых мы разделили на группы по полу и возрасту: 25-45 лет и 45-65 лет, по 16 человек в каждой. Деление обследованных по полу и возрасту было необходимым, чтобы показать различие измеряемых параметров в разных половозрастных группах. Исследование состояло из двух этапов:
В результате исследования впервые из общей гетерогенной популяции клеток кожи были получены отдельные субпопуляции и определен фенотип клеток из нативного и криоконсервированного образца (табл. 1).
Жизнеспособность в нативном образце составила 99,8%, после криоконсервации – 87,0%. При сравнении данных процентного соотношения клеток кожи двух образцов существенного расхождения в показателях не обнаружено, за исключением клеток, экспрессирующих на своей поверхности HLA-DR антигены и молекулы адгезии, то есть являющихся антигенпрезентирующими.
Основными звеньями иммунной системы кожи являются кератиноциты и фибробласты, которые регулируют физиологические функции кожи, а продуцируемые ими вещества – сигнальными молекулами для локальной координации межклеточных и межтканевых взаимодействий. Причем эти субпопуляции клеток кожи являются резидентами разных ее слоев, а их согласованное взаимодействие определяет способность поддерживать гомеостаз кожи и реагировать на воздействие внешней и внутренней среды. В качестве примера демонстрируем наблюдение количества кератиноцитов и фибробластов в исследуемых образцах (табл. 2).

Как видно, количество кератиноцитов в эпидермисе с течением времени уменьшается. Результаты достоверны в группах сравнения 25-45 и 45-65 у обоих полов, а также в группах сравнения 25-45 и 45-65 между мужчинами и женщинами. Необходимо отметить, что у мужчин количество кератиноцитов в эпидермисе больше, чем у женщин, на 4%. Это можно объяснить тем, что анатомически толщина кожи у мужчин выражена значительнее, чем у женщин. Причем у мужчин количество кератиноцитов в эпидермисе с возрастом уменьшается на 16,3%, а у женщин на 23,6%. Такое снижение клеток, возможно, связано с различием гормонального фона между полами.
Количество фибробластов в дерме также демонстрирует возрастное снижение. Результаты достоверны в группах сравнения 25-45 и 45-65 у обоих полов, а также в группах сравнения 25- 45 и 45-65 между мужчинами и женщинами. У мужчин количество клеток больше по сравнению с женщинами на 4%. Динамика снижения с возрастом – у мужчин количество фибробластов в дерме уменьшается на 13,9%, а у женщин – на 17%.
В большей степени происходит снижение количества кератиноцитов в эпидермисе, чем фибробластов в дерме. Причем у женщин эти изменения более выражены с возрастом. Скорее всего, это связано с тем, что кожа является гормонально зависимым органом, но эти результаты предстоит определить точнее.
Таким образом, предлагаемый способ позволяет получить информацию о количественном составе и функциональной активности клеток кожи, что объективно свидетельствует о текущем статусе местного иммунитета пациента и может стать основой для лечебно-профилактической программы, разработанной индивидуально.
Цитоиммунограмма кожи, как способ диагностики кожи, проста в исполнении и доступна, позволяет оценить качественный и количественный состав ее отдельных субпопуляций клеток, оценить их функцию и степень их реагирования в ответ на какие-либо воздействия внешней и внутренней среды.
Изобретение цитоиммунограммы кожи открывает для практической дерматологии и косметологии путь к новому пониманию процессов, проходящих в коже человека, дает возможность количественно оценить показатели состояния кожи не только в рамках отдельного человека, но и в рамках популяции, не только в условиях нормы, но, что немаловажно, в условиях патологии. Тем более что в роли системы хемокинов в коже, например в патогенезе псориаза, уже нет никаких сомнений [2].
Возможность исследовать криоконсервированный образец позволяет сделать повторное исследование спустя некоторое время или после каких-либо процедур, воздействий, применении наружных препаратов или косметических средств и, сравнив данные, позволит врачу объективно оценивать изменения.
Широкомасштабное применение цитоиммунограммы в перспективе позволит создать половозрастной регистр состояния кожи в норме и патологии, что позволит определять степень реагирования кожи на воздействия среды, измерять активность клеточных субпопуляций нативной кожи в условиях нормы и патологии, использовать критерий возрастных изменений кожи, объективно оценивать динамику заболевания кожи, индивидуально подбирать лекарственный препарат и контролировать эффективность применяемых наружных лекарственных средств.

Что определяет нашу жизнь? Конечно же новые отношения и порождаемые ими события. Но, именно смерть, своим неотвратимым пределом накладывает на нашу жизнь важное обстоятельство – жить её в максимально возможной полноте и яркости.
Детально разобрав механизм универсального кожного зуда, а также основанные на его понимании подходы в диагностике и лечении, появилась потребность разобрать и другие «зудящие дерматозы». Однозначен ли объединяющий их термин – зудящие? узнать ответ...

Friends, I have a great event! Every letter matters, but today is a special day – the first time in my life I received a letter from the ruling monarch. More...

Грешно на себя ссылаться, но как-то писал ранее, что человек (та ещё тварь) не стремится к добру или злу, а стремится к максимальному диапазону ощущений... читать далее