В связи с увеличением количества трансплантаций гемопоэтических стволовых клеток (ГСК) пуповинной крови (ПК) и расширением показаний к их клиническому применению проблема создания банков длительного хранения стволовых клеток является весьма актуальной [1, 2]. Успех трансплантаций аллогенных ГСК ПК во многом зависит от качества и безопасности заготовленного клеточного материала [3, 4, 5].
Криоконсервирование является неотъемлемой частью процедуры длительного хранения клеточных биоматериалов. В большинстве случаев клетки сохраняют свою морфологию после замораживания-размораживания, но может наблюдаться снижение их жизнеспособности и нарушение клеточных функций, приводящее к снижению пролиферативных свойств и нарушению биологической активности.
Вопросы сохранности ГСК ПК на этапе их криоконсервирования и хранения, а также оценка их пролиферативного потенциала и способности к дифференцировке in vitro и in vivo требуют постоянного изучения и совершенствования.
В исследовании использовалось 40 образцов пуповинной крови, полученных во время физиологических срочных родов. Информированное согласие рожениц на сбор пуповинной крови и проведение эксперимента было получено.
Сбор образцов пуповинной крови проводился в родильных домах г. Тюмени. Для исследований отбирались образцы, объем которых превышал 80 мл. ПК собирали в систему для сбора крови (Green Cross, Корея), содержащую стандартное количество гемоконсерванта CPDA (цитратно-фосфатно-декстрозно-адениновый раствор).
Выделение ГСК ПК проводили методом ав- томатического выделения клеток с помощью клеточного сепаратора «SepaxS1000» (Biosafe, Швейцария).
В качестве криопротектора к концентрату ядросодержащих клеток ПК добавляли высокоочищенный диметилсульфоксид (ДМСО) в сочетании с полиглюкином. Конечная концентрация ДМСО в криоконсервируемой среде составляла 5%. Для криоконсервирования концентрата клеток пуповинной крови использовались два способа замораживания: спонтанное замораживание в парах жидкого азота и криоконсервирование в программном замораживателе PLANER Krio 560-16 (ENGLAND) автоматическим контролем про- цесса охлаждения каждого образца клеток. Количество и жизнеспособность ГСК ПК оценивали), методом проточной цитометрии на проточном цитофлуориметре Beckman Coulter FS-500 Cytomics (Beckman Coulter, США) с помощью набора Stem-Kit TM Reagents (Beckman Coulter, США).
С целью изучения пролиферативного потенциала ГСК ПК определяли длину их теломер и колониеобразующую способность (КОЕ). КОЕ ГСК пуповинной крови определяли с помощью культивирования клеточной суспензии в метилцеллюлозе в течение 14 сут. при температуре 37 °С в СО2 инкубаторе с подсчетом количества колониеобразующих единиц (КОЕ) на 1 × 105: КОЕ-ГМ – гранулоцитарных-макрофагальных, КОЕ-Г – гранулоцитарных, КОЕ-М – макрофагальных, КОЕ-Эр –эритроцитарных, КОЕ-mix – смешанных. Для определения абсолютного количества гемопоэтических предшественников в 1 мл пуповинной крови, полученные величины КОЕ умножали на число мононуклеарных клеток в 1 мл крови.
Для определения длины теломер использовался набор PNA Kit/FITC (DAKO, Дания). Гибридизация клеток с теломерным зондом проводилась в соответствии с рекомендациями фирмы DAKO. В образцах, гибридизиро- ванных с теломерным зондом, производилось определение длины теломер на проточном цитофлуориметре Beckman Coulter FS-500 Cytomics (Beckman Coulter, Швейцария). Для исследования использовался световой фильтр с длиной волны 488 нм. Интенсивность флуоресценции выставляли при флуоресцентном сигнале в FL-1. Гейтировали клетки в G0/1 фазе клеточного цикла, где клетка имеет только одну копию своего генома. Оценка количества жизнеспособности и пролиферативной активности проводилась до и после криоконсервации.
Математическую обработку данных проводили при помощи программы Kaluzav. 1.2 (Beckman Coulter, США). Статистическую обработку данных проводили при помощи программного обеспечения Statistica 6.1 (StatSoft).
Средний срок криохранения образцов ГСК ПК составил от 6 до 12 мес., средний объем криоконсервированных образцов – 19,9±1,1 мл. Жизнеспособность (CD45+7AAD-) ядросо- держащих клеток ПК до (96,3±3,1%) и после криоконсервации в программном замораживателе и парах азота составила (89,0±3,4% и 77,4±3,4%) соответственно (рис. 1). Абсолютное количество CD34+-клеток после автоматической криоконсервации ПК снижалось с 0,18±0,05 × 106/мл до 0,11±0,03 × 106/мл и до 0,08±0,04 × 106/мл в парах азота.
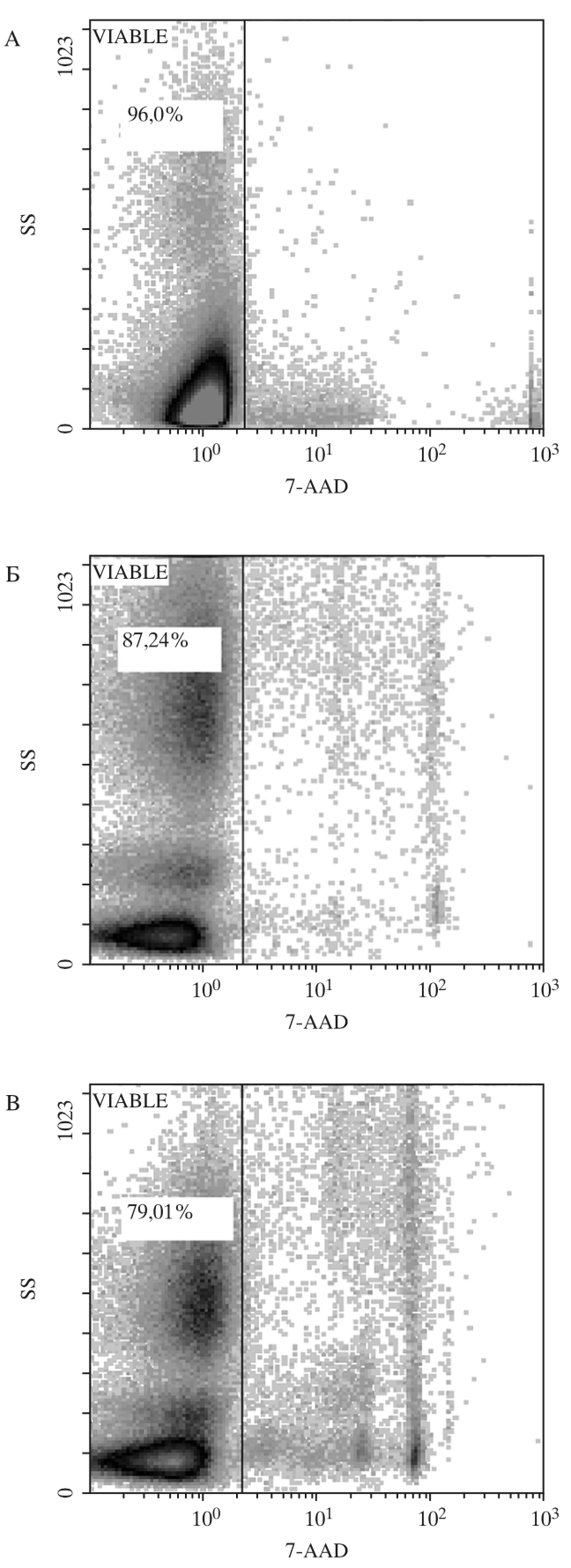
Рис. 1. Гистограмма жизнеспособности ядросодержащих клеток CD45+ пуповинной крови негативных по реакции с 7-ADD (А), нативный образец (Б) клетки криоконсервированные в программном замораживателе, (В) клетки криоконсервированные в парах азота.
КОЕ ГСК является достоверным показате- лем их пролиферативного потенциала. При исследовании КОС ГСК до замораживания среднее количество колоний на 1 × 105 ГСК ПК составило 40,28±2,45, КОЕ ГСК ПК, криоконсервированных в программном замораживателе в среднем составила 39,66±1,09 при криоконсервировании в парах жидкого азота – 21,86±2,71 соответственно. При оценке КОЕ клеток ПК было показано, что количество колоний после криоконсервации в автоматизированной системе снижается не значительно в сравнении с замораживанием в парах азота (табл. 1, рис. 2).
Таблица 1. Влияние различных способов криоконсервирования на КОЕ ГСК ПК
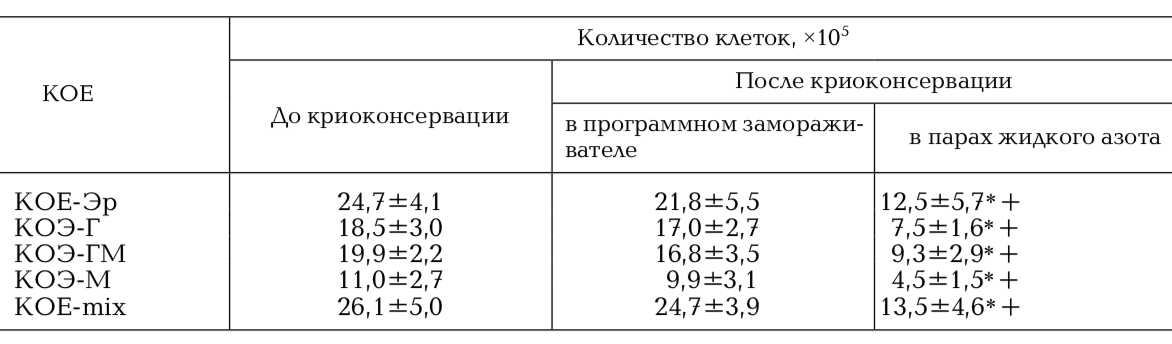
Примечание: *р < 0,01по сравнению с образцом до криоконсервации; + р < 0,01по сравнению с образцом после криоконсервации в программном замораживателе. КОЕ-ГМ – гранулоцитарно-макрофагальные, КОЕ-Г – гранулоцитарные, КОЕ-М – макрофагальные, КОЕ-Эр – эритроцитарные, КОЕ-mix – смешанные колониеобразующие единицы.
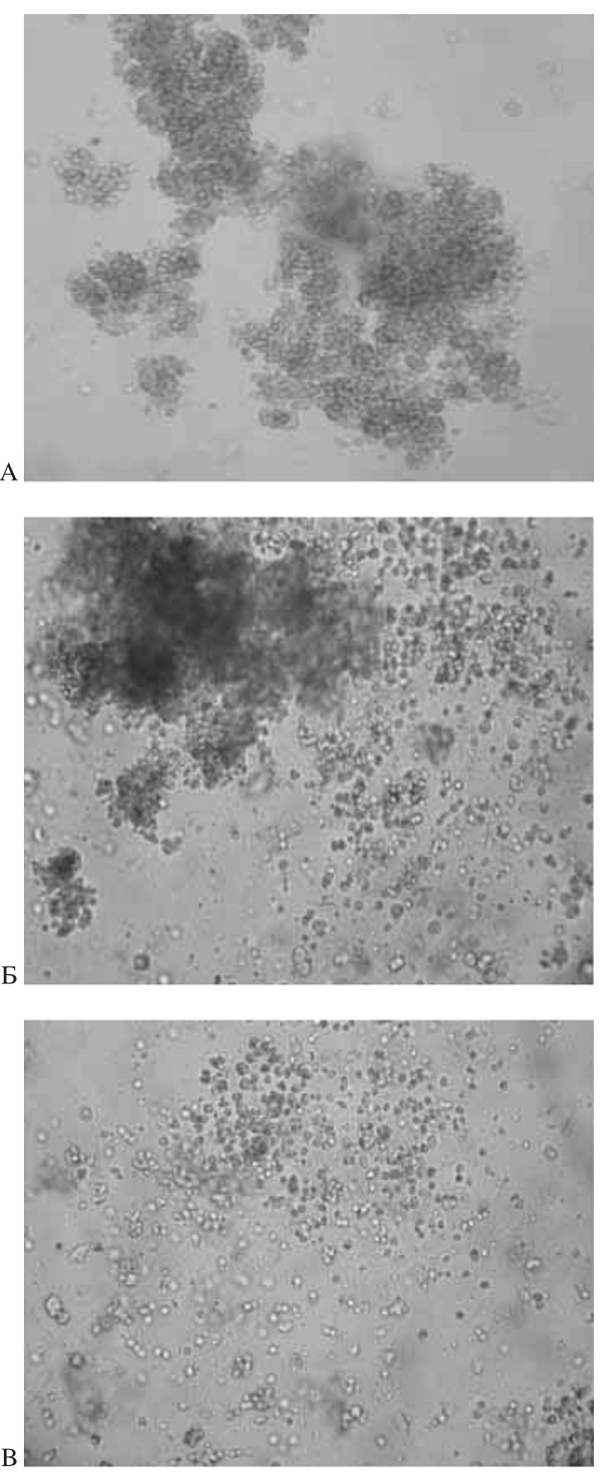
Рис. 2. ГСК ПК. КОЕ А – до и после криоконсер- вации, Б – в программном замораживателе, В – парах азота.
Исследования зарубежных ученых сопо- ставимо с полученными результатами. В Японии при оценке качества 54 криоконсервированных образцов ПК из 9 различных банков ПК. Было показано, что процент сохранения ядросодержащих клеток, CD34+-клеток и КОЕ-ГМ составил 96,0±11,3%, 83,0±17,0% и 88,6±41,2%, соответственно [6].
Определение длины теломер ГСК ПК проводили с использованием новейшей методики сочетания флуоресцентной гибридизации in situ и проточной цитометрии. Для изучения влияния криоконсервирования на репликативный потенциал ГСК, зависящий от длины их теломер, нами было исследовано 40 образцов пуповинной крови. Выявлено достоверное уменьшение длины теломер в клетках после криоконсервирования (рис. 3, табл. 2).
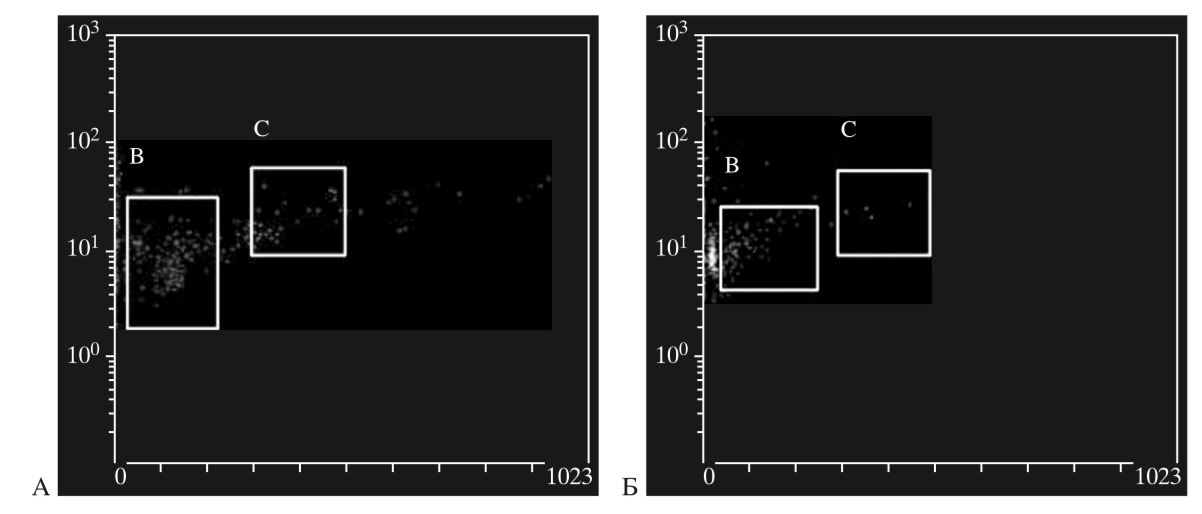
Рис. 3. Гистограммы идентификации клеток культуры, находящихся в G0/1-фазе клеточного цикла. Прямое светорассеяние, гейтирование области, в которой находятся клетки в фазе G 0/1 клеточного цикла. A– клетки перед криоконсервированием; Б – клетки после криоконсервирования
Таблица 2. Длина теломер ГСК ПК

При криоконсервировании клеток в программном замораживателе изменение пролиферативного потенциала ГСК ПК менее выражено, чем при замораживании в парах жидкого азота. Как известно, охлаждение биологического объекта с любой скоростью всегда сопровождается образованием разнообразных кристаллов льда. В момент перехода растворенной в клетке воды в кристаллическую форму – достижении точки эвтектики – происходит выделение дополнительного тепла за счет образования кристаллической решетки при переходе воды из жидкого состояния в твердое. Основные повреждения клетки наступают в точке перекристаллизации, так как в этот период образуются концентрированные растворы солей, которые повреждают клеточные структуры. Этот период не должен длиться более 1,5 мин [7, 8, 9]. В проведенных нами исследованиях при замораживании в программном замораживателе время от наступления точки эвтектики и кристаллизации сокращено до 1,5 мин, а при замораживании в парах жидкого азота это время длилось более 5 мин.
Укорочение длины теломер при замораживании клеток ПК может быть связано с процессами повреждения ядерной мембраны [4, 10], так, как именно она повреждается при криоконсервировании в первую очередь [7]. Процессы криоконсервирования клеток могут приводить к транзиторным или органическим поражениям этих структур, и таким образом вызывать апоптоз клеток, что, безусловно, сказывается на их восстановлении после размораживания [8]. Уменьшение длины теломер возможно, приводит к изменению экспрессии генов, что также может сказаться на функции клетки [4, 10].