Подлинная философия должна быть практичной
Теслинов А.Г.
В переводе с древне-греческого, прагматика, означающая – «дело, действие», изучает отношения между знаковыми системами и теми, кто их использует. Высоко оценивая процедуру измерений, выдающийся российский учёный Д.И. Менделеев (1834–1907) писал: «Наука началась тогда, когда люди научились мерить; точная наука немыслима без меры». Однако измерений абсолютно точных не бывает, как бы тщательно ни проводился эксперимент или опыт. Неточность результатов эксперимента или опыта и, следовательно, относительность естественно-научной истины обусловливается двумя факторами: объективным и субъективным. Тем более, что стандартным методом проверки любых открытий является прямая экспериментальная проверка, как говорится, эксперимент – критерий истины.
Методом проточной цитометрии проводилось фенотипирование клеточной суспензии с использованием специфических маркеров CD3, CD4, CD8, CD14, CD16, CD19, CD34, CD44, CD45, CD49, CD54, CD63, CD80, CD146, CD203c, CD207, CD249, с помощью которых идентифицировались субпопуляции клеток и определялся их фенотип. На этом основании была определена панель маркеров дифференцирования клеток, наиболее точно характеризующих динамику состояний основных субпопуляций клеток кожи:
кератиноциты CD49f+, из них активированные CD49f+HLA-DR+;
фибробласты CD45-CD14-CD44+, из них активированные CD45-CD14-CD44+CD80+;
тучные клетки CD249+, из них активированные CD249+CD63+;
моноциты CD45+CD14+, из них активированные CD45+CD14+HLA-DR+;
внутриэпидермальные макрофаги CD207+, из них активированные CD207+CD80+, CD207+HLA-DR+, CD207+CD80+HLA-DR+;
эндотелиальные клетки CD146+, из них активированные CD146+CD34+, CD146+HLA-DR+, CD146+CD54+, CD146+CD54+HLA-DR+;
эпителиальные клетки CD34+CD45dim;
лимфоцитарные популяции: Т-лимфоциты CD45+CD3+, Т-хелперы CD45+CD3+CD4+CD8-, Т-супрессоры CD45+CD3+CD4-CD8+, В-лимфоциты CD45+CD3-CD19+, NK-лимфоциты CD45+CD3-CD16+CD56+.
Для регистрации получаемых результатов был разработан бланк медицинского документа «Цитоиммунограмма кожи», в котором представлен состав клеток кожи, с указанием фенотипа каждой субпопуляции для заполнения лаборантом числовых данных в относительных и/или абсолютных единицах по результатам исследования (рис. 3.1).

Рисунок 3.1. Бланк медицинского документа «Цитоиммунограмма кожи».
В верхней части документа указаны реквизиты медицинского учреждения, знак обслуживания, почтовый адрес, контактные телефоны, сайт медицинского учреждения, а также свободные участки для заполнения лаборантом идентификационного номера цитоиммунограммы кожи с датой проведения анализа, фамилии имени отчества пациента и его возраста.
В средней части документа в две колонки представлен состав клеток кожи, с указанием фенотипа каждой популяции. Напротив каждой группы клеток кожи предусмотрены пустые поля в виде сдвоенных прямоугольников для заполнения лаборантом числовых данных в относительных и/или абсолютных единицах по результатам экспериментов. Представленные числовые данные указывают количество клеток кожи определенного фенотипа.
В нижней части документа имеются свободные участки, предназначенные для заполнения информации о результатах исследования фенотипа клеток кожи, которые могут свидетельствовать: о динамической оценке течения заболевания, эффективности использования назначенных лекарственных или косметических средств, оценке возрастных изменений кожи, индивидуальном подборе лекарственных препаратов, оценке степени реагирования клеток кожи на те или иные воздействия. А также заполняются лаборантом в свободные участки сведения об исполнителе и враче, направившим на проведение анализа.
После пробоподготовки, описанной ранее, методом проточной цитометрии определяли количество жизнеспособных клеток кожи у одного из 80 добровольцев (рис. 3.2). Результат составил 94%.

Рисунок 3.2. Относительное количество всех жизнеспособных (7AAD) клеток в суспензии образца кожи полученное методом проточной цитометрии
Также регистрировали количество клеток определенных фенотипов, используя наборы моноклональных антител меченые флюорохромами и связывающиеся с определёнными рецепторами на мембране клетки.
Показано, что в образце кожи 54,2% кератиноцитов, из них в состоянии активности 41,4% (рис. 3.3).

Рисунок 3.3. Соотношение относительного количества жизнеспособных кератиноцитов (фенотип CD49f+) и их активированных форм (фенотип CD49f+HLA-DR+) в суспензии клеток биоптата кожи человека, полученное методом проточной цитометрии
Также в образце кожи, среди 86% жизнеспособных фибробластов, 6,2% в состоянии активности (рис. 3.4 и 3.5).

Рисунок 3.4. Относительное количество жизнеспособных (7AAD) фибробластов (фенотип CD45-CD14-CD44+) в суспензии клеток биоптата кожи человека, полученное методом проточной цитометрии
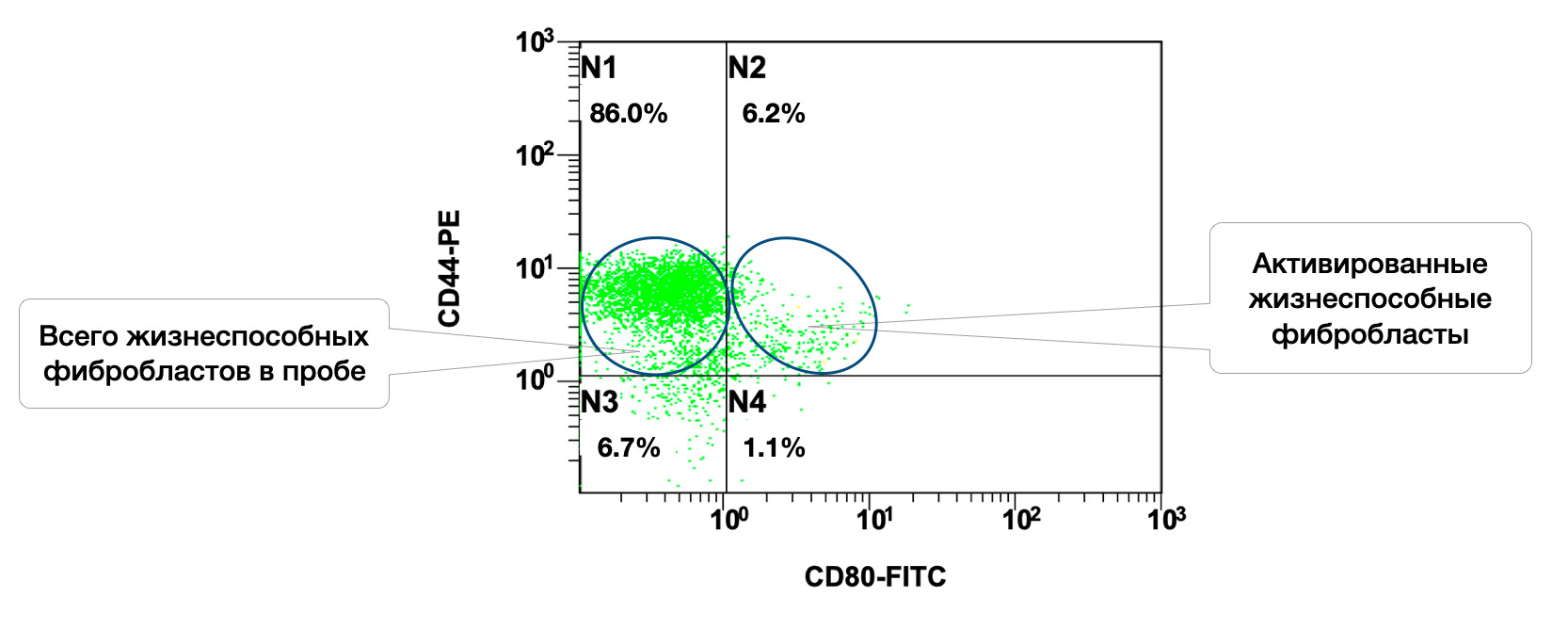
Рисунок 3.5. Соотношение относительного количества жизнеспособных фибробластов (фенотип CD45f-CD14-CD44+) и их активированных форм (фенотип CD45f-CD14-CD44+CD80+) в суспензии клеток биоптата кожи человека, полученное методом проточной цитометрии
В этом же образце кожи 78,5% жизнеспособных тучных клеток среди всех тучных клеток в пробе, но из них в состоянии активности только 1,1% (рис. 3.6 и 3.7).
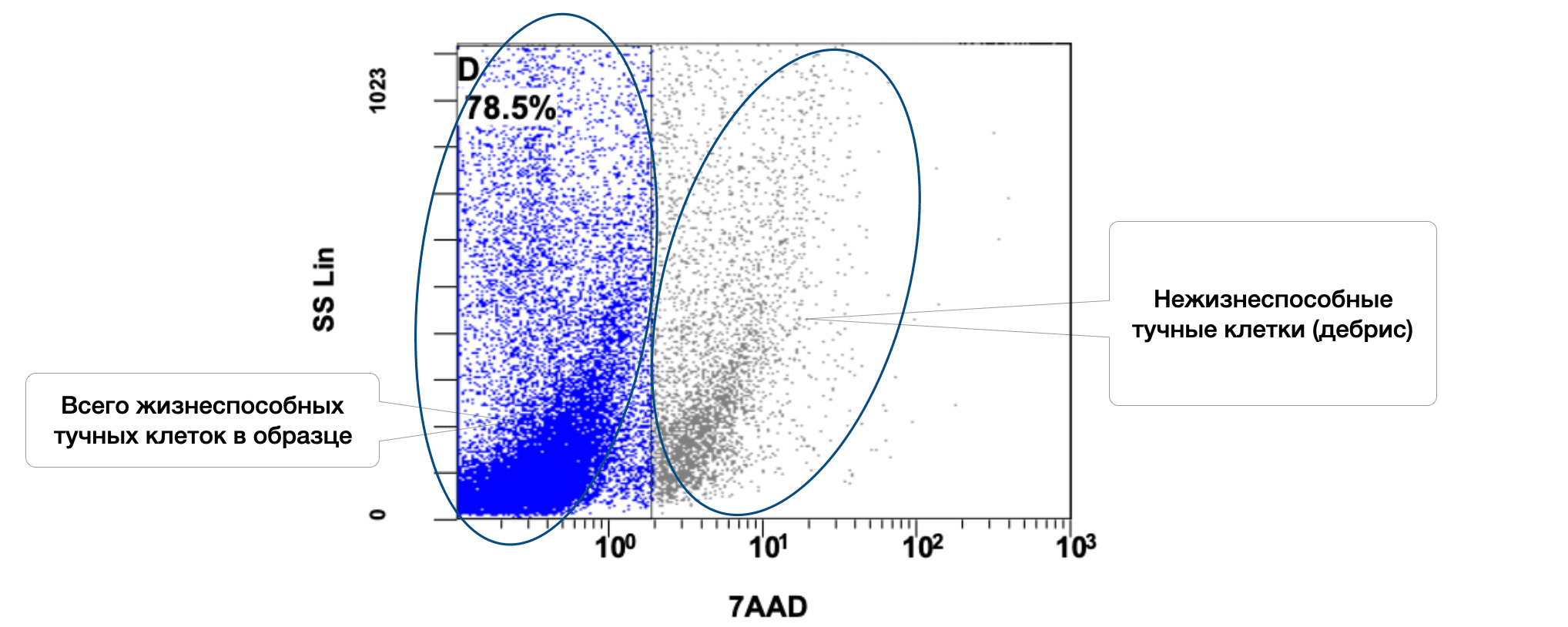
Рисунок 3.6. Относительное количество жизнеспособных (7AAD) тучных клеток (фенотип CD249+) в суспензии клеток биоптата кожи человека, полученное методом проточной цитометрии
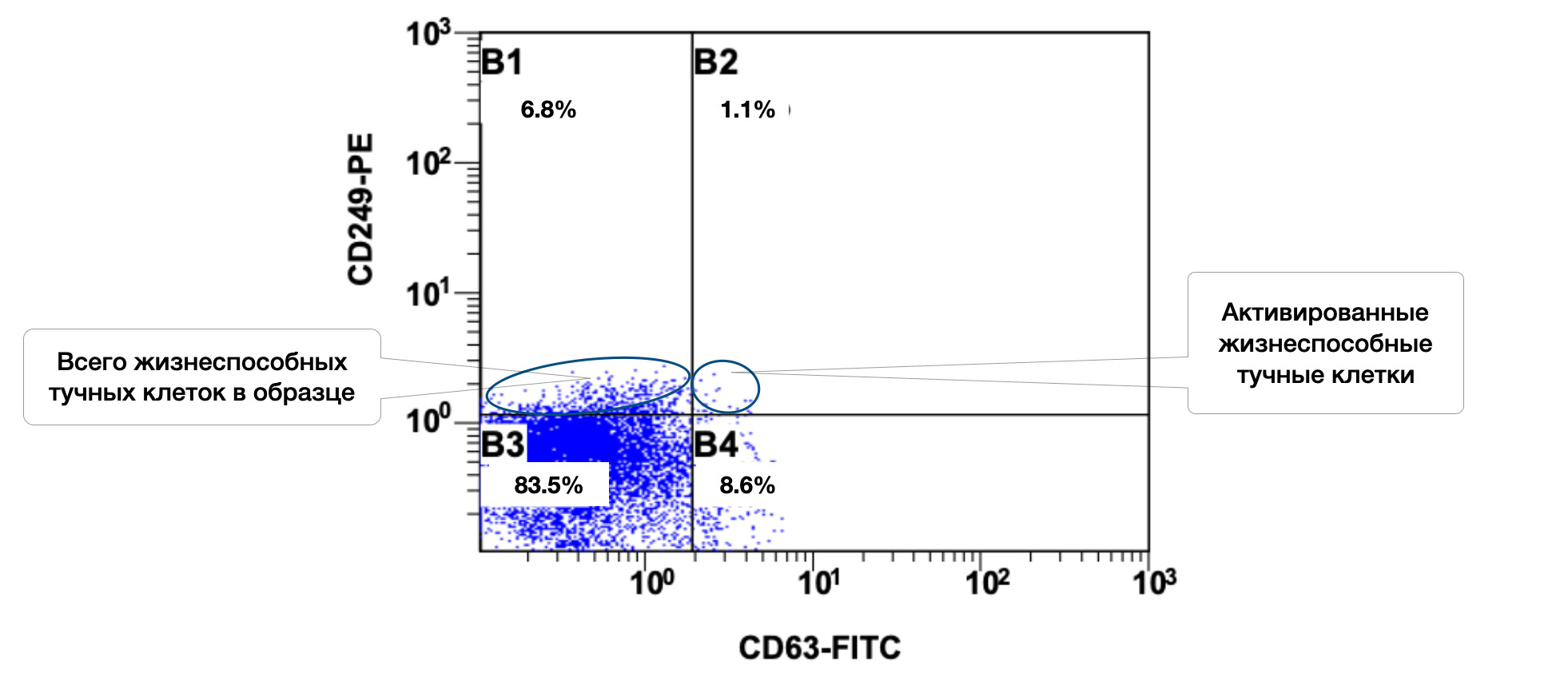
Рисунок 3.7. Соотношение относительного количества жизнеспособных тучных клеток (фенотип CD249+) и их активированных форм (фенотип CD249+CD63+) в суспензии биоптата кожи человека, полученное методом проточной цитометрии
Одновременно, в образце кожи 7% моноцитов, из них в состоянии активности 2,6% (рис. 3.8).
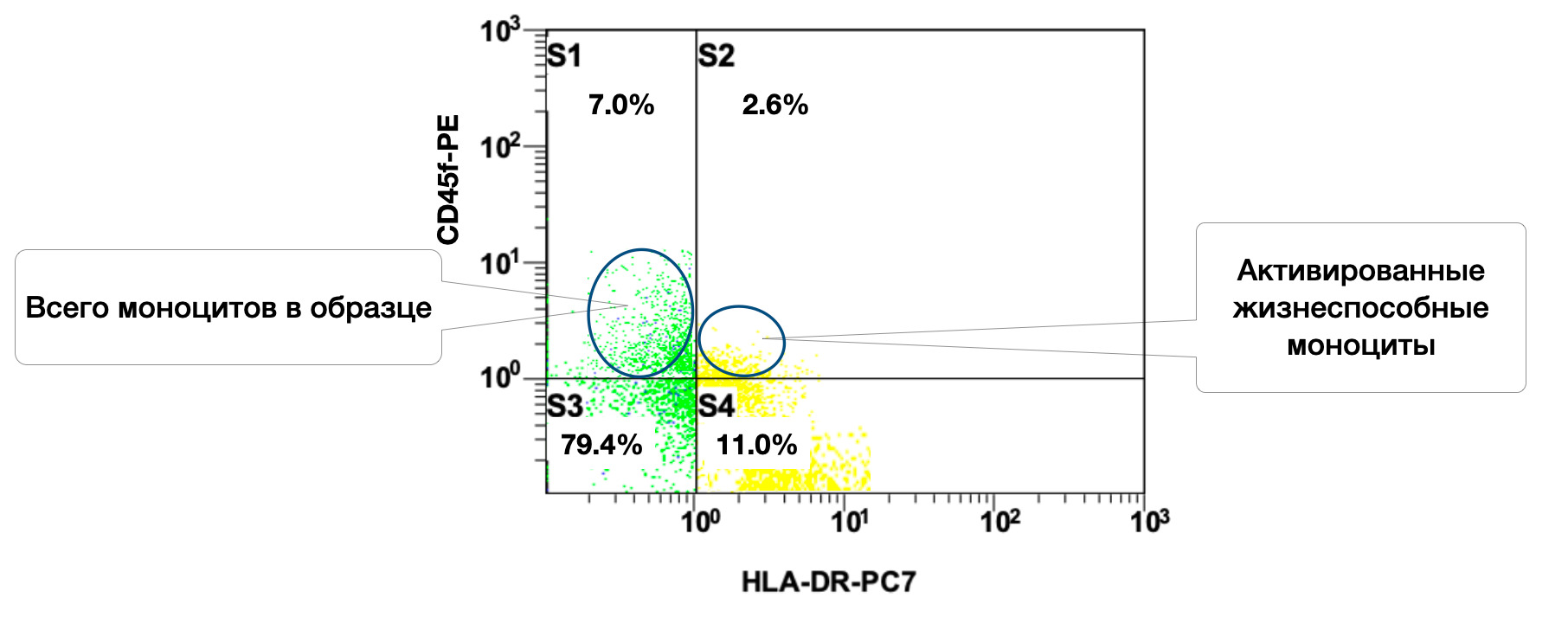
Рисунок3.8. Соотношение относительного количества жизнеспособных моноцитов (фенотип CD45+CD14+) и их активированных форм (фенотип CD45+CD14+HLA-DR+) в суспензии биоптата кожи человека, полученное методом проточной цитометрии
Жизнеспособных внутриэпидермальных макрофагов в образце кожи 47,9%, из них в состоянии активности 4,9% (рис. 3.9).
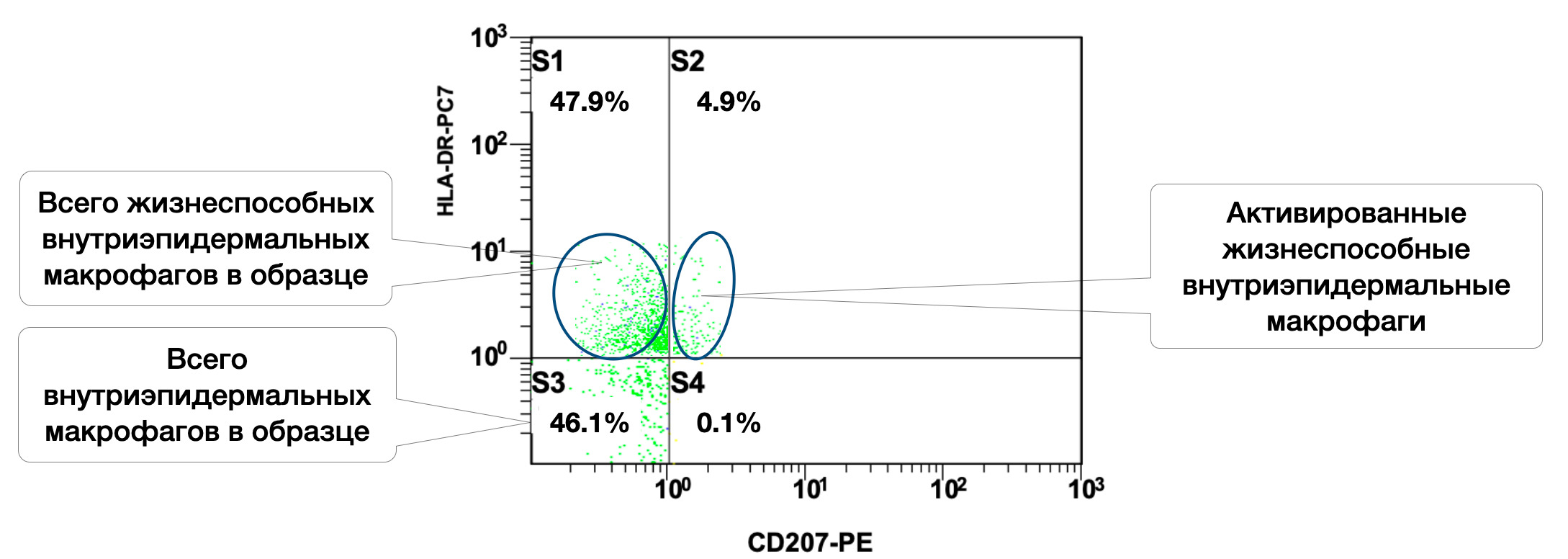
Рисунок 3.9. Соотношение относительного количества жизнеспособных внутриэпидермальных макрофагов (фенотип CD207+) и их активированных форм (фенотип CD207+HLA-DR+) в суспензии биоптата кожи человека, полученное методом проточной цитометрии
Также в данном образце кожи эндотелиальные клетки представлены в активированном состоянии 5,4 % одним и 5,9 % двумя признаками, но всего жизнеспособных эндотелиоцитов 60,3% (рис. 3.10).
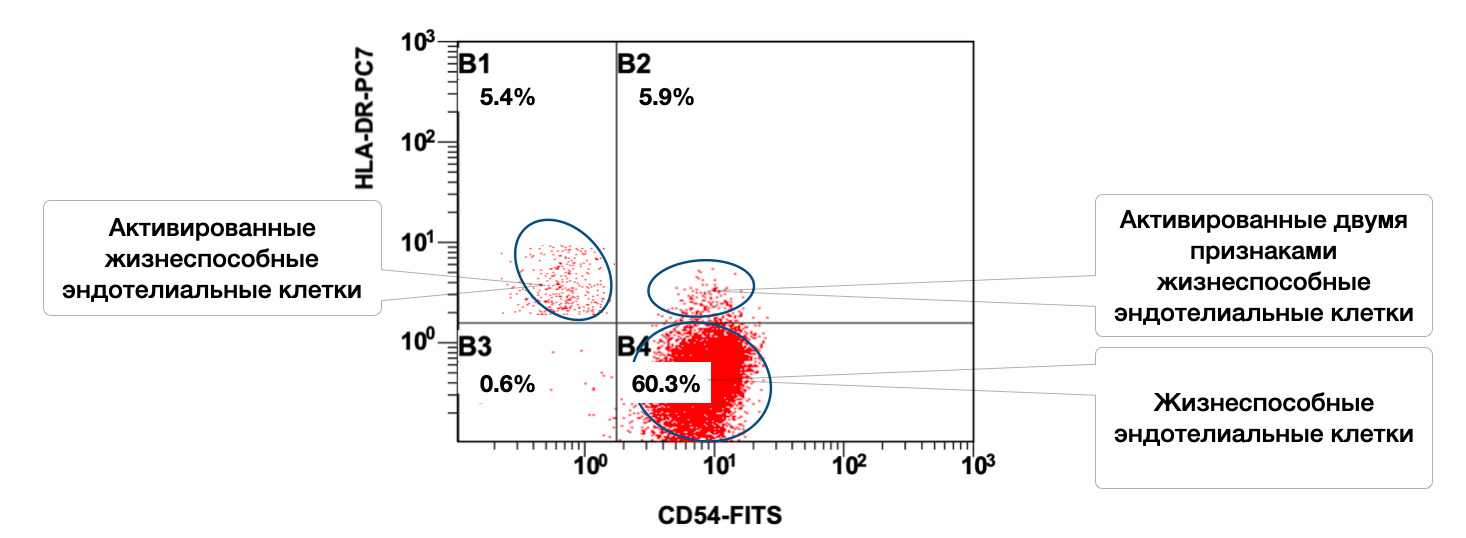
Рисунок 3.10. Соотношение относительного количества жизнеспособных эндотелиальных клеток (фенотип CD146+) и их активированных форм (фенотипы CD146+HLA-DR+; CD146+CD54+; CD146+CD54+HLA-DR+) в суспензии биоптата кожи человека, полученное методом проточной цитометрии
Общие результаты исследованной суспензии клеток выделенных субпопуляций были представлены на бланке (рис. 3.11).

Рисунок 3.11. Результаты цитоиммунограммы кожи на бланке
Приведенные, в качестве демонстрации возможностей проточной цитометрии для дерматологии, результаты обследования одного условно здорового обследуемого показывают, что в данном образце кожи:
активно представлена субпопуляция кератиноцитов, причем большинство из них активированы, что говорит о пролиферативной активности базального слоя эпидермиса;
присутствуют B-лимфоциты, которые в норме являются резидентами циркулирующего объема крови и лимфы, поскольку имеют положительный таксис к высоко-эндотелиальным венулам, находящимся преимущественно в лимфатических узлах. Наличие их в коже указывает на активность гуморального иммунитета;
присутствие несколько разновидностей T-лимфоцитов (CD3+ лимфоцитов), локализующихся преимущественно в трех наружных слоях эпидермиса, и тот факт, что CD4+ клетки несколько превалируют численно над CD8+ клетками, говорит об усилении адаптивного иммунитета кожи;
низкое содержание Т-супрессоров свидетельствует об отсутствии инфекционно-воспалительного процесса;
остальные показатели демонстрируют количество специфических клеток кожи, но при этом их низкую активацию, что в совокупности с отсутствием специфических жалоб у данного пациента свидетельствует о нормальном состоянии его кожи.
Далее к исследованию были привлечены 80 здоровых добровольцев, выделены группы по полу и возрасту 25-45 лет и 45-65 лет, по 16 человек в каждой. Был выполнен забор биоптата кожи у каждого участника, из которого были выделены субпопуляции клеток, определен их фенотип в нативном и криоконсервированном образцах. Результаты фенотипирования легли в основу построения цитоиммунограмм кожи и сводных таблиц. Период наблюдения и оценки данных составил не более 1 года.
В результате, впервые из общей гетерогенной популяции клеток кожи были получены отдельные жизнеспособные субпопуляции клеток из нативного и криоконсервированного образца у 80 условно здоровых лиц. Был определен фенотип клеток, их функциональная активность и жизнеспособность. (табл. 3.1).
Таблица 3.1. Сравнительная оценка количественного и функционального состояния жизнеспособных клеток в нативных и криоконсервированных биоптатах кожи условно здоровых лиц, n=80

* относительное количество субпопуляций клеток от общего количества клеток данного вида в биоптате
При сравнении данных процентного соотношения клеток кожи двух образцов, существенного расхождения в показателях не обнаружено. Отмечено, что жизнеспособность в нативных образцах составила – 99,8±0,9%, а после криоконсервации – 87,0%±0,5. Этот результат позволяет рекомендовать криоконсервацию в качестве способа сохранения образца для дальнейших наблюдений в динамике.
Деление обследованных по полу и возрасту было необходимым, чтобы показать различие измеряемых параметров в разных половозрастных группах.
При этом, среднестатистическая характеристика (табл. 3.2) сделана для демонстрации возможностей скрининговых подходов в оценке фенотипа субпопуляций клеток кожи.
Таблица 3.2. Среднестатистическая характеристика фенотипов основных субпопуляций клеток кожи в биоптате условно здоровых лиц с распределением по полу и возрасту полученная в результате скринингового исследования (n=80).


** относительное количество субпопуляций клеток от общего количества клеток данного вида в биоптате* наблюдаемые различия статистически значимы – p<0,05
Способ получения сведений о фенотипе клеток кожи различных субпопуляций закладывает основу именно индивидуального подхода в исследованиях кожи и диагностике её патологических состояний. Тем не менее, представленные результаты обнаружили, что количество кератиноцитов в эпидермисе с возрастом уменьшается. Практически каждая субпопуляция демонстрирует снижение функциональной активности с возрастом. Результаты достоверны в группах сравнения 25-45 и 45-65 у обоих полов, а также в группах сравнения 25-45 и 45-65 между мужчинами и женщинами.
Важным для дерматологии, при появлении новых методов исследования и диагностики, является формирование реестра нормативных показателей. Проведенное исследование условно здоровых лиц с использованием разработанной панели позволило определить среднестатистические значения параметров фенотипического статуса кожи человека. Результаты, представленные в таблице, требуют уточнения, но начало положено.
Становится очевидным, что определение фенотипа клеток кожи является не только диагностическим признаком, позволяющим судить о течении воспалительных и не воспалительных процессов, происходящих в коже. Также, полученные результаты демонстрируют новые исследовательские возможности способа получения гетерогенной популяции клеток кожи человека и способа определения субпопуляционного состава клеток кожи и получения цитоиммунограммы кожи.